题目内容
11.回答下列有关重要化工原料甲醇的有关问题(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示
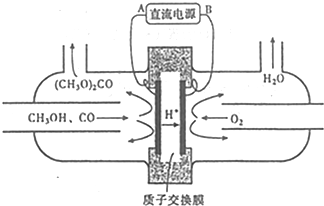
电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
分析 (1)①反应热=反应物总键能-生成物总键能;
②起始时投入2molH2、1molCO,二者按2:1反应,故平衡时二者物质的量之比为2:1,二者分压之比为2:1,设平衡时CO分压为p,则氢气分压为2p,结合平衡常数计算CO分压,相同条件下,压强之比等于物质的量之比,进而计算平衡混合气体中CH3OH的物质的量分数;
增大压强反应速率加快,正反应为气体物质的量减小的反应,平衡正向移动;
(2)①Ⅱ等效为在I的基础上压强增大一倍,反应前后气体体积不变,平衡不移动,反应物转化率不变;
②计算浓度商Qc,与平衡常数比较,若Qc=K,处于平衡状态,若Qc>K,反应向逆反应进行,若Qc<K,反应向正反应进行;
③计算207℃时该反应的化学平衡常数,与387℃时平衡常数K=4比较,判断反应是吸热反应还是放热反应,应改变温度使Ⅱ中平衡正向移动;
(3)由结构示意图可知,电解池左侧发生氧化反应、右侧发生还原反应,则电解池左侧为阳极,连接电源的正极,右侧为阴极,连接电源的负极,阳极是甲醇、CO失去电子生成(CH3O)2CO与氢离子;
根据电子转移守恒计算生成(CH3O)2CO的物质的量,再根据m=nM计算其质量.
解答 解:(1)①反应热=反应物总键能-生成物总键能,则△H=2×436kJ.mol-1+1076kJ.mol-1-3×413kJ.mol-1-343kJ.mol-1-465kJ.mol-1=-99kJ.mol-1,
故答案为:-99;
②起始时投入2molH2、1molCO,二者按2:1反应,故平衡时二者物质的量之比为2:1,二者分压之比为2:1,设平衡时CO分压为p,则氢气分压为2p,该反应的平衡常数Kp=6.0×10-3(kPa)-2,反应达到平衡时p(CH3OH)=24.0kPa,则$\frac{24kPa}{(2p)^{2}×p}$=6.0×10-3(kPa)-2,解得p=10kPa,相同条件下,压强之比等于物质的量之比,故平衡时H2、CO、CH3OH的物质的量之比为20:10:24=10:5:12,则平衡混合气体中CH3OH的物质的量分数为$\frac{12}{10+5+12}$=44.4%;
增大压强使反应体系各组分浓度增大,反应速率加快,正反应为气体物质的量减小的反应,压强增大平衡正向移动,H2、CO的转化率增大,CH3OH的产率增大,
故答案为:44.4%;增大压强使反应体系各组分浓度增大,反应速率加快,正反应为气体物质的量减小的反应,压强增大平衡正向移动,H2、CO的转化率增大,CH3OH的产率增大;
(2)①Ⅱ等效为在I的基础上压强增大一倍,反应前后气体体积不变,平衡不移动,反应物转化率不变,设转化率为a,则x=2a,y=4a,故$\frac{x}{y}$=$\frac{1}{2}$,
故答案为:$\frac{1}{2}$;
②浓度商Qc=$\frac{0.15×0.1}{0.{1}^{2}}$=1.5<K=4,故反应向正反应进行,故答案为:正;
③207℃时,平衡时甲醚与水均为0.09mol,则消耗的甲醇为0.18mol,平衡时甲醇为0.02mol,则平衡常数K=$\frac{0.09×0.09}{0.0{2}^{2}}$=20.25,大于387℃时平衡常数,说明降低温度平衡向正反应进行,故正反应为放热反应,容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可在温度方面的措施为:降低温度,
故答案为:降低温度;
(3)由结构示意图可知,电解池左侧发生氧化反应、右侧发生还原反应,则电解池左侧为阳极,连接电源的正极,右侧为阴极,连接电源的负极,B为电源的负极,阳极是甲醇、CO失去电子生成(CH3O)2CO与氢离子,电极反应式为:2CH3OH+CO-2e-=(CH3O)2CO+2H+,
消耗氧气为$\frac{1120}{22.4L/mol}$=50mol,根据电子转移守恒可知,生成(CH3O)2CO的物质的量为$\frac{50mol×4}{2}$$\frac{50mol}{2}$=100mol,则制得(CH3O)2CO的质量为100mol×90g/mol=9000g=9Kg,
故答案为:B;2CH3OH+CO-2e-=(CH3O)2CO+2H+;9.
点评 本题考查化学平衡计算与影响因素、反应热计算、电化学等,侧重考查学生解决问题能力,难度中等.

| A. | 取代反应 | B. | 加成反应 | C. | 聚合反应 | D. | 置换反应 |
| 氧化物 | CaO | Al2O3 | SiO2 | H2O |
| 质量分数 | 0.1420 | 0.2602 | 0.4592 | 0.1378 |
①普通化学式CaAl2Si3O10•3H2O(或CaAl2H6Si3O13);
②氧化物表示式CaO•Al2O3•3SiO2•3H2O.
 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
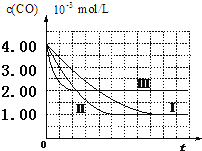
(2)由图可知,第Ⅰ组实验中,CO的平衡浓度为1.00×10-3mol/L,计算达平衡时NO的浓度为3.5×10-3mol/L.
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
| A. | 1molCl2参加反应转移电子数一定为2NA | |
| B. | 1mol甲烷分子所含质子数为10NA | |
| C. | 0.1molFe粉与足量水蒸气反应生成H2分子数为0.1NA | |
| D. | 含0.4molAl3+的Al2(SO4)3中含SO42-的物质的量是0.6NA |
| A的用量 | B的用量 | A2B的质量 | |
| 甲 | 7.0 g | 1.0 g | 5.0 g |
| 乙 | 4.0 g | 4.0 g | 5.0 g |
| 丙 | a g | b g | 3.0 g |

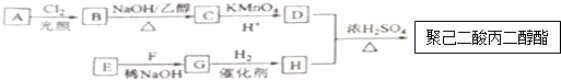
 $\stackrel{△}{→}$
$\stackrel{△}{→}$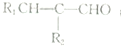
 .
. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图(不能超过5步).
)的合成路线示意图(不能超过5步). →
→ +H2O
+H2O