题目内容
12.下表列出了A-R九种元素在元素周期表中的位置,试用元素符号或化学式回答下列问题:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
分析 由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、G为Cl、H为Br、R为Ar.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强;稀有气体原子最外层为稳定结构,化学性质最不活泼;由E的位置可知其处于第二周期ⅣA族;
(2)非金属性越强,最高价氧化物对应水化物的碱性越强;
(3)H的氢化物为HBr;利用单质之间的相互置换反应进行验证;
(4)D的原子序数为13,F的原子序数为8.
解答 解:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、G为Cl、H为Br、R为Ar.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中K的金属性最强;稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;由E的位置可知其处于第二周期ⅣA族,
故答案为:K;Ar;二;ⅣA;
(2)金属性Na>Mg>Al,非金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,含有离子键、共价键,
故答案为:NaOH;离子键;共价键;
(3)H的氢化物为HBr,结构式为H-Br;利用单质之间的相互置换反应进行验证,反应离子方程式为:Cl2+2NaBr=2NaCl+Br2,
故答案为:H-Br;Cl2+2NaBr=2NaCl+Br2;
(4)D的原子序数为13,F的原子序数为8,二者原子序数之差为13-8=5,故答案为:5.
点评 本题考查元素周期表与元素周期律的综合应用,比较基础,注意对元素周期表的整体把握.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池两极均发生氧化还原反应 | |
| C. | 原电池中的阳离子向正极移动 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
20. 由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
 由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )| A. | Y极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池放电时,H+由Y极区流向X极区 | |
| C. | 每消耗1mol乙醇,转移电子4mol | |
| D. | 用该电池做电源电解精炼铜,X极应与粗铜连接 |
7.有a、b、c、d四种金属.将a与b用导线接起来,浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应强烈.将铜浸入b的盐溶液里,无明显变化.如果把铜浸入c的盐溶液里,有金属c析出.据此判断它们的活动性顺序由强到弱的为( )
| A. | a>c>d>b | B. | d>a>b>c | C. | d>b>a>c | D. | b>a>d>c |
17.已知H-H键能为436kJ/mol,H-N键能为391kJ/mol,根据热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,则N≡N键的键能是( )
| A. | 431 kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
1.NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)?2N2(g)+6H2O(g)现向一容积不变的2L密闭容器中充入4mol NH3和3mol O2,4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率的式子,正确的是( )
| A. | v(N2)═0.225 mol/(L•min) | B. | v(H2O)═0.375 mol/(L•min) | ||
| C. | v(O2)═0.225 mol/(L•min) | D. | v(NH3)═0.450 mol/(L•min) |
2. 已知下列数据:
已知下列数据:
学生在实验室制取乙酸乙酯的主要步骤如下:
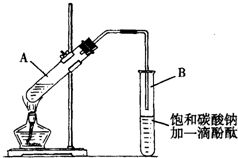
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D、加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:减少乙酸乙醇的挥发,减少副反应的发生.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D、加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:减少乙酸乙醇的挥发,减少副反应的发生.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.

 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为 .
.
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
.