题目内容
2. 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | -- | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
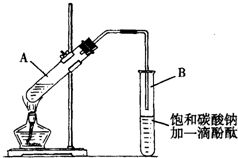
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):BC
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D、加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是:减少乙酸乙醇的挥发,减少副反应的发生.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.
分析 (1)乙酸和乙醇在浓硫酸的催化作用下反应生成乙酸乙酯和水;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
(3)乙醇、乙酸的沸点较低,易挥发;
(4)根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析.
解答 解:(1)乙酸和乙醇在浓硫酸的催化作用下反应生成乙酸乙酯和水,其反应方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,易于分离,
故答案为:BC;
(3)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应,所以为防止乙醇、乙酸挥发,造成原料的损失,应小火加热,
故答案为:减少乙酸乙醇的挥发,减少副反应的发生;
(4)碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,有香味,振荡时乙酸和碳酸钠反应而使溶液红色变浅;
故答案为:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.
点评 本题主要考查了乙酸乙酯的制备,掌握乙酸乙酯的制备原理,以及运用原理理解实验装置的改进创新思路是解答的关键,题目难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
12.下表列出了A-R九种元素在元素周期表中的位置,试用元素符号或化学式回答下列问题:
(1)在这九种元素中,最活泼的金属,其元素符号是K;最不活泼的元素,其元素符号是Ar;E元素位于周期表中第二周期第ⅣA族.
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
13.诺贝尔生理和医学奖的最大一次失误是1948年授予了瑞士化学家米勒,由于米勒发明了剧毒有机氯杀虫剂DDT而获得当年诺贝尔奖,但后来发现DDT是一种难降解的化合物,毒性残留时间长,现世界各国现已明令禁止生产和使用.DDT的结构简式为 ,下列关于DDT的说法中正确的是:( )
,下列关于DDT的说法中正确的是:( )
 ,下列关于DDT的说法中正确的是:( )
,下列关于DDT的说法中正确的是:( )| A. | DDT分子中两苯环不可能共平面 | |
| B. | DDT分子属于芳香烃 | |
| C. | 若使原苯环上的两个氯原子连接在同一个苯环上,共有6种同分异构体 | |
| D. | DDT难以降解的原因是DDT难以发生水解反应 |
10. 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )| A. | 放出1 638 kJ的热量 | B. | 吸收1 638 kJ的热量 | ||
| C. | 放出126 kJ的热量 | D. | 吸收126 kJ的热量 |
7.下列说法不正确的是( )
| A. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c (Na+)=c(CH3COO-)+c(CH3COOH) | |
| B. | 将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中粒子的物质的量浓度大小关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 将纯水加热至较高温度,水的离子积变大,pH变大,呈中性 | |
| D. | 将稀氨水加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$ 增大 |
14.已知金刚石在一定条件下转化为石墨是放热的.据此以下说法正确的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热,须看反应物和生成物所具有的总能量的相对大小 | |
| D. | 金刚石比石墨稳定 |
12.下列关于分子组成表示为CxHy的烷、烯、炔烃说法不正确的是( )
| A. | 当x≤4时,均为气体(常温常压下) | |
| B. | y一定是偶数 | |
| C. | 分别燃烧1mol,耗氧气(x+$\frac{y}{4}$)mol | |
| D. | 在150℃时的密闭容器中完全燃烧后恢复到原温度,测得的压强一定比燃烧前增大 |

 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.
 、
、 、
、 .
.