题目内容
7.有a、b、c、d四种金属.将a与b用导线接起来,浸入电解质溶液中,b不易腐蚀.将a、d分别投入等浓度的盐酸中,d比a反应强烈.将铜浸入b的盐溶液里,无明显变化.如果把铜浸入c的盐溶液里,有金属c析出.据此判断它们的活动性顺序由强到弱的为( )| A. | a>c>d>b | B. | d>a>b>c | C. | d>b>a>c | D. | b>a>d>c |
分析 原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属.
解答 解:两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将a与b用导线连接起来浸入电解质溶液中,b不易腐蚀,所以a的活动性大于b;
金属和相同的酸反应时,活动性强的金属反应剧烈,将a、d分别投入等浓度盐酸溶液中,d比a反应剧烈,所以d的活动性大于a;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入b的盐溶液中,无明显变化,说明b的活动性大于铜.如果把铜浸入c的盐溶液中,有金属c析出,说明铜的活动性大于c;
所以金属的活动性顺序为:d>a>b>c,
故选B.
点评 本题考查了金属活泼性强弱的判断,难度不大,金属活泼性强弱的判断方法有:原电池中的正负极材料、金属之间的置换反应、金属和酸反应置换出氢气的难易等.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
2.将一溴丙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果没有看到浅黄色沉淀生成,其主要原因是( )
| A. | 加热时间太短 | B. | 不应冷却后再滴入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀HNO3酸化 | D. | 加AgNO3溶液后未加稀HNO3 |
12.下表列出了A-R九种元素在元素周期表中的位置,试用元素符号或化学式回答下列问题:
(1)在这九种元素中,最活泼的金属,其元素符号是K;最不活泼的元素,其元素符号是Ar;E元素位于周期表中第二周期第ⅣA族.
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
19.体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时,( )
| A. | 两者消耗NaOH的物质的量相同 | |
| B. | 中和HCl消耗NaOH的物质的量多 | |
| C. | 中和CH3COOH消耗NaOH的物质的量多 | |
| D. | 两者消耗NaOH的物质的量无法比较 |
16.下列说法错误的是( )
| A. | 酸雨是指pH<5.6雨 | |
| B. | 在正常情况下人体血液pH为7.35~7.45 | |
| C. | 有色水泥主要是因为水泥中含有CuCl2 | |
| D. | 红色玻璃主要是因为玻璃中含有少量Cu2O |


 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.
 、
、 、
、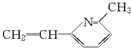 .
.