题目内容
【题目】费托合成是以合成气(CO 和 H2 混合气体)为原料在催化剂和适当条件下合成烯烃(C2~C4)以及烷烃(CH4、C5~C11、C12~C18 等,用Cn H2n+2 表示)的工艺过程。
已知:① 2CO(g) +O2(g) =2CO2 (g) △H1 =a
②2H2(g) + O2(g)=2H2O(g) △H2 =b
③![]()
回答下列问题:
(1)反应(2n +1)H2 (g)+nCO(g)=CnH2n+2(g)+nH2O(g)的 △H_____。(用含有a、b、c、n 的式子表示)
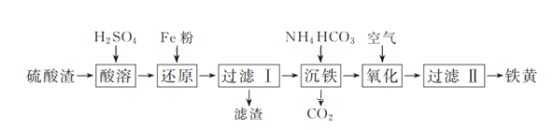
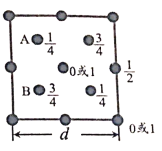
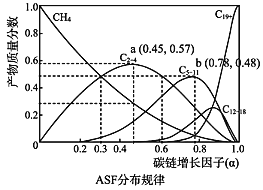
(2)费托合成产物碳原子分布遵循 ASF 分布规律。碳链增长因子(α)是描述产物分布的重要参数,不同数值对应不同的产物分布。ASF 分布规律如图,若要控制 C2~C4 的质量分数 0.48~0.57,则需控制碳链增长因子(α)的范围是________。
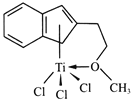
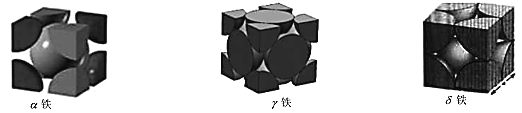
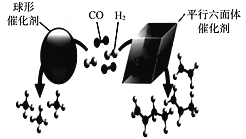
(3)近期,我国中科院上海高等研究院在费托合成烃的催化剂上取得重大进展。如图所示,Co2C作催化剂的规律是:选择球形催化剂时_____,选择平行六面体催化剂时_____。
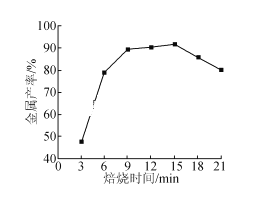
(4)中科院大连化物所研究团队直接利用CO2 与H2 合成甲醇。一定条件下,向 2L 恒容密闭容器中充入1molCO2和 2mol H2发生反应“CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H”。CO2 的平衡转化率(α)与温度(T)的关系如图所示。
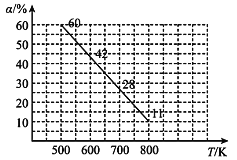
①判断△H_______0。(填“大于”“小于”或“等于”)
②500 K 时,反应 5 min 达到平衡。计算 0~5 min 用H2O 表示该反应的化学反应速率为_________,该反应的平衡常数为__________。
③500 K 时,测定各物质的物质的量浓度分别为 c(CO2)=0.4 mol/L、c(H2) = 0.2 mol/L、c(CH3OH) = 0.6 mol/L、c(H2O) = 0. 6 mol/L,此时反应____ (填“是”或“否”) 达到平衡,理由是_____ 。
④一定条件下,对于反应 CO2(g) + 3H2(g)CH3OH(g) + H2O(g)。下列说法中不能表明反应达到平衡的是_____。
a.恒温恒容下,c(CH3OH)=c(H2O)
b.恒温恒容下,体系的压强保持不变
c.恒温恒容下,体系的平均摩尔质量不变
d.相同时间内,断裂 H-H 键和断裂 H-O 键之比 1:1
【答案】![]() 0.3~0.6 主要产物为CH4 产物有CH2=CH2、C3H6、C4H8 小于 0.06 mol/(L ·min) 450(mol/L)-2 否
0.3~0.6 主要产物为CH4 产物有CH2=CH2、C3H6、C4H8 小于 0.06 mol/(L ·min) 450(mol/L)-2 否 ![]() ≠450
≠450![]() a
a
【解析】
(1)根据盖斯定律解答;
(2)由图可知要控制C2~C4的质量分数0.48~0.57是对应的数值范围;
(3)根据图示球棍模型的比例判断产物的分子式;
(4) ①右图可知随着温度升高CO2的平衡转化率降低,平衡逆向移动分析;
②根据![]() 计算;
计算;
③列 “三段式”,求算500K时平衡常数,比较Qc与平衡常数的大小判断;
④根据达到平衡状态时的特点分析。
(1)已知:① 2CO(g) +O2(g) =2CO2 (g) △H1 =a
②2H2(g) + O2(g)=2H2O(g) △H2 =b
③![]()
根据盖斯定律:![]() ×①+
×①+![]() ×②-③,可得反应(2n+1)H2(g)+nCO(g)=Cn
×②-③,可得反应(2n+1)H2(g)+nCO(g)=Cn![]() (g)+nH2O(g)的△H=
(g)+nH2O(g)的△H=![]() ;
;
(2)由图可知要控制C2~C4的质量分数0.48~0.57需控制碳链增长因子(α)的范围是0.3~0. 6;
(3)CO2C作催化剂的规律是:选择球形催化剂时主要产物为CH4,选择平行六面体催化剂时产物有CH2 =CH2、CH2 = CHCH3、CH2=CHCH2CH3或C2H4、C3H6、C4H8。
(4)①右图可知随着温度升高CO2的平衡转化率降低,故△H小于0。
②500 K 时,二氧化碳转化率为60%,即参与反应的物质的量为0.6mol,根据反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),水蒸气的变化物质的量为0.6mol,则![]() =0.06 mol/(L·min)。
=0.06 mol/(L·min)。
③初始时刻, CO2和H2的物质的量浓度分别为0.5mol/L、1 mol/L,500 K 时,二氧化碳转化率为60%,列“三段式”:
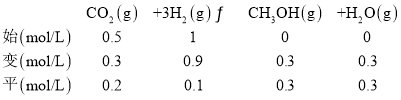
![]() ,代入数据
,代入数据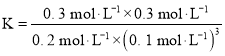
![]() ;
;![]() ≠
≠![]() ,反应未达到平衡状态;
,反应未达到平衡状态;
④反应CO2(g)+ 3H2(g)![]() CH3OH(g)+H2O(g)气体分子数减小。
CH3OH(g)+H2O(g)气体分子数减小。
a.若平衡正向建立必有c(CH3OH)=c(H2O),不能表明反应已达平衡,故a错误;
b.恒温恒容下,压强p~n,n必然变化,当p不变,表明反应已达平衡,故b正确;
c.反应物、产物均为气体,气体质量不变,n减小(增大),M=![]() 即M必然变化,当M不变,表明反应已达平衡,故c正确;
即M必然变化,当M不变,表明反应已达平衡,故c正确;
d.断裂H-H键(v正)断裂H-O键(v逆)1∶1,v正= v逆,表明反应已达平衡,故d正确;
答案选a。