题目内容
【题目】以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
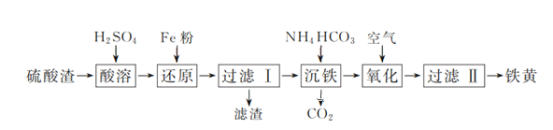
(1)“酸溶”中加快溶解的方法为____(写出一种)。
(2)“还原”过程中的离子方程式为_______。
(3)①“沉铁”过程中生成Fe(OH)2的化学方程式为_______。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中c(Ca2+)/c(Fe2+)=________。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是_________。
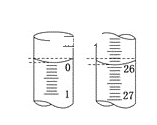
(5)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、n(C)/n(O)=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是_______。

【答案】加热或搅拌或适当增大硫酸浓度(写一种) Fe+2Fe3+=3Fe2+ FeSO4+2NH4HCO3=Fe(OH)2↓+(NH4)2SO4+2CO2↑ 140 NaNO2被还原为氮氧化物,污染空气 还原剂消耗完,空气进入使铁再次氧化
【解析】
(1)硫酸渣中Fe2O3溶于硫酸生成硫酸铁溶液,SiO2不溶于硫酸,加入过量铁粉,硫酸铁被还原为硫酸亚铁,滤液中加入碳酸氢铵,生成Fe(OH)2沉淀和二氧化碳,通入氧气Fe(OH)2被氧化为FeOOH。
(1)加热、搅拌或适当增大硫酸浓度可加快“酸溶”中溶解速率。
(2)“还原”过程中硫酸铁被铁粉还原为硫酸亚铁,反应的离子方程式为Fe+2Fe3+=3Fe2+。
(3)①“沉铁”过程中硫酸亚铁、碳酸氢铵反应生成Fe(OH)2、二氧化碳、硫酸铵,反应的化学方程式为FeSO4+2NH4HCO3= Fe(OH)2↓+(NH4)2SO4+2CO2↑。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液为碳酸钙、碳酸亚铁的饱和溶液,溶液中![]() ;
;
(4)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,NaNO2被还原为氮氧化物,污染空气。
(5)焦炭还原硫酸渣炼铁,在1225℃、n(C)/n(O)=1.2时,焙烧时间超过15min,还原剂消耗完,空气进入使铁再次氧化,所以金属产率下降。