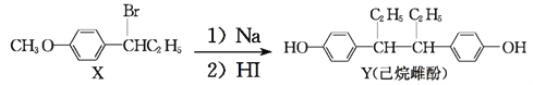题目内容
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
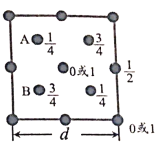
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
【答案】2 ![]() O或氧 1个3s 3个3p
O或氧 1个3s 3个3p ![]()
![]() 低
低 ![]() 是一种空间网状的共价晶体,共价键结合较为牢固
是一种空间网状的共价晶体,共价键结合较为牢固 ![]()
【解析】
⑴根据化合物中各元素的化合价代数和为零来计算n值,Cu2+ 的价电子排布式根据铜原子的价电子排布式3d104s1 得出。
⑵“中国蓝”中![]() 、Si都不存在孤对电子,而O原子中存在孤对电子。
、Si都不存在孤对电子,而O原子中存在孤对电子。
⑶SiO2是空间网状结构,一个Si原子周围连有4个O原子。Si原子核外最外层有4个电子,恰好与氧原子形成4个σ键,无孤对电子。而杂化轨道用于形成σ键和容纳孤对电子。所以SiO2中Si的杂化类型是sp3,也就是1个3s轨道和3个3p轨道形成。
⑷含有硫元素的阴离子是正四面体,最可能是硫酸根。
⑸碳酸根中C提供4个电子,O不提供电子,加两个负电荷,6个电子形成3对电子,属于sp2杂化,平面正三角形,键角为![]() ,对于碱土金属,同主族从上到下离子半径递增,碳酸盐的热稳定性递增,
,对于碱土金属,同主族从上到下离子半径递增,碳酸盐的热稳定性递增,![]() 比
比![]() 稳定。
稳定。
⑹![]() 是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为
是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为![]() ,在z轴方向上距离为
,在z轴方向上距离为![]() ,所以SiA与SiB之间的距离
,所以SiA与SiB之间的距离![]() 。
。
⑴根据化合物中所有元素化合价代数和为0可计算出Cu的化合价为+2,故Cun+离子中n=2,Cu的价电子排布式3d104s1,当失去2个电子时价电子排布式变为![]() ,故答案为2,
,故答案为2,![]() ;
;
⑵“中国蓝”中![]() ,Si都不存在孤对电子,而O原子中存在孤对电子,所以只能氧原子来提供孤对电子,故答案为:O;
,Si都不存在孤对电子,而O原子中存在孤对电子,所以只能氧原子来提供孤对电子,故答案为:O;
⑶SiO2中Si的杂化类型是sp3,也就是1个3s轨道和3个3p轨道形成,故答案为:1个3s,3个3p;
⑷含有硫元素的阴离子是正四面体,最可能是硫酸根,所以钡矿化学式是![]() ,故答案为:
,故答案为:![]() ;
;
⑸碳酸根中C属于sp2杂化,平面正三角形,键角为![]() ,对于碱土金属碳酸盐的热稳定性
,对于碱土金属碳酸盐的热稳定性![]() 比
比![]() 稳定,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低,故答案为:
稳定,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低,故答案为:![]() ,低;
,低;
⑹![]() 是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为
是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为![]() ,在z轴方向上距离为
,在z轴方向上距离为![]() ,所以SiA与SiB之间的距离
,所以SiA与SiB之间的距离![]() ,故答案为:
,故答案为:![]() 是一种空间网状的原子晶体,共价键结合较为牢固,
是一种空间网状的原子晶体,共价键结合较为牢固,![]() ;
;

 星级口算天天练系列答案
星级口算天天练系列答案【题目】类比推理是学习化学的重要的思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
陈述Ⅰ | 类比推理陈述Ⅱ | |
A | 单质的熔点Br2 < I2 | 单质的熔点Li < Na |
B | 工业上电解熔融的Al2O3得到铝单质 | 工业上电解熔融的MgO得到镁单质 |
C | 还原性:I- > Br- | 还原性:P3- > N3- |
D | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
A.AB.BC.CD.D