题目内容
【题目】硫酸铵是一种传统的氮肥,某种制取硫酸铵的流程如下:
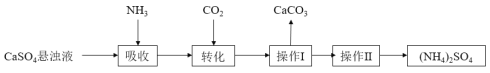
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)在CaSO4悬浊液中通入NH3、CO2生成(NH4)2SO4的化学方程式________________。
(3)为测定硫酸铵的纯度,称取3.000g样品,溶于水,依次加入足量稀盐酸和足量BaCl2溶液,充分反应,过滤,沉淀经洗涤后烘干至恒重,得到4.660 g BaSO4。该硫酸铵的纯度为_______________。
【答案】过滤 CaSO4+2NH3+CO2+H2O = CaCO3↓+(NH4)2SO4 88%
【解析】
制取(NH4)2SO4晶体的流程分析可知,硫酸钙悬浊液通入氨气吸收,再通入二氧化碳转化生成碳酸钙和硫酸铵,过滤得到溶液通过蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸铵的晶体,据此解答。
(1)操作Ⅰ为固液分离,其操作名称为过滤;
(2)CaSO4悬浊液中通入NH3,溶液中生成NH3H2O,再通入CO2时,CO2与NH3H2O反应生成![]() ,
,![]() 与溶液中Ca2+反应生成CaCO3,整个过程的化学方程式为:CaSO4+2NH3+CO2+H2O = CaCO3↓+(NH4)2SO4;
与溶液中Ca2+反应生成CaCO3,整个过程的化学方程式为:CaSO4+2NH3+CO2+H2O = CaCO3↓+(NH4)2SO4;
(3)4.660gBaSO4的物质的量为![]() =0.02mol,根据硫酸根离子守恒可知样品中n[(NH4)2SO4]=0.02mol,m[(NH4)2SO4]=0.02mol×132g/mol=2.64g,则硫酸铵的纯度为
=0.02mol,根据硫酸根离子守恒可知样品中n[(NH4)2SO4]=0.02mol,m[(NH4)2SO4]=0.02mol×132g/mol=2.64g,则硫酸铵的纯度为![]() =88%。
=88%。

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目