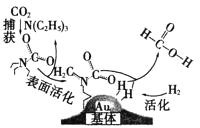
题目内容
【题目】实验室常利用“棕色环”现象检验NO3— 离子。其方法为:取含有 NO3— 的溶液于试管中,加入 FeSO4 溶液振荡,然后沿着试管内壁加入浓 H2SO4,在溶液的界面上岀现“棕色环”。回答下列问题:
(1)基态 Fe2+核外未成对电子个数为_____。
(2)形成“棕色环”主要发生如下反应:
3[Fe( H2O)6]2+ + NO3-+4H+ =3[Fe(H2O)6]3+ + NO ↑+2H2O
[Fe( H2O)6]2+ + NO=[Fe(NO) (H2O)5]2+(棕色)+ H2O
[Fe(NO)(H2O)5]2+中,配体是______、______,配位数为______。
(3)与 NO 互为等电子体的微粒是_____ (任写一例)。
(4)SO42-的空间构型是_____,其中 S 原子的杂化方式是________ 。
(5)铁原子在不同温度下排列构成不同晶体结构,在 912℃以下排列构成的晶体叫做α-铁; 在 912℃至 1394℃之间排列构成的晶体叫做γ -铁;在 1394℃以上排列构成的晶体, 叫做δ-铁。晶胞剖面结构如图所示:
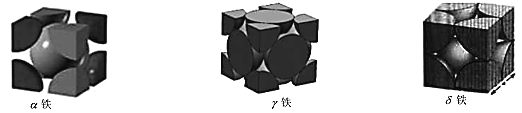
①α-铁的原子堆积方式为 _____ 。δ-铁配位数为 ____ 。
②已知γ-铁晶体密度为d g/cm3,则 Fe 原子的半径为____nm(用含 d、NA 的式子表示)。
【答案】4 NO H2O 6 O![]() 或N
或N![]() 正四面体 sp3杂化 体心立方堆积 6
正四面体 sp3杂化 体心立方堆积 6 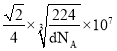
【解析】
(1)基态Fe原子核外电子排布式为[Ar]3d64s2,根据洪特规则判断;
(2)[Fe(NO)(H2O)5]2+中配体为NO、H2O,配合物中配位数等于配体的个数之和;
(3)价电子数和原子个数相等的微粒为等电子体,利用等电子原理分析解答;
(4)利用中心原子价层电子互斥理论判断杂化类型和空间结构;
(5)①根据图示,α-铁和δ-铁的铁原子堆积方式为体心立方堆积;
②晶胞棱长为acm,根据![]() ,
,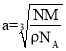 ,结合图示,面对角线是4个铁原子的半径,则铁原子半径=
,结合图示,面对角线是4个铁原子的半径,则铁原子半径=![]() 。
。
(1)基态Fe原子核外电子排布式为[Ar]3d64s2 ,基态Fe2+ 核外电子排布式为[Ar]3d6,根据洪特规则,成单电子数为4;
(2)[Fe(NO)(H2O)5]2+中配体为NO、H2O,配合物中配位数等于配体的个数之和,则配位数为5+1=6;
(3)NO为双原子价电子总数为(5+6),其等电子体可能是O![]() (6+6-1)或N
(6+6-1)或N![]() (5+5+1);
(5+5+1);
(4)SO![]() 的中心硫原子价层电子对数为4+
的中心硫原子价层电子对数为4+![]() (8-4×2)=4,S的杂化方式为sp3,空间构型是正四面体;
(8-4×2)=4,S的杂化方式为sp3,空间构型是正四面体;
(5)①α-铁和δ-铁的铁原子堆积方式都为体心立方堆积,δ-铁配位数为6;
②如图所示,该晶胞中含有6个铁原子,晶胞棱长为acm,根据![]() ,则
,则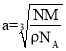 =
=![]() cm,面对角线是4个铁原子的半径,Fe原子半径
cm,面对角线是4个铁原子的半径,Fe原子半径![]() cm,即
cm,即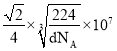 nm。
nm。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案