题目内容
4.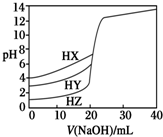 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |
分析 A、根据图象分析,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,PH越小酸性越强;
B、根据氢氧化钠滴到10mL时,c(HX)≈c(X-),Ka(HX)≈c(H+);
C、HY为弱电解质,V(NaOH)=20mL时,HY与氢氧化钠恰好完全反应生成NaY,Y-水解溶液显示碱性;
D、滴定HZ,V(NaOH)=10mL时,HZ为强电解质,HZ有一半参与反应,溶液中氢离子来自HY和水电离的两部分,所以c(H+)>c(Na+).
解答 解:A、氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,故A错误;
B、当NaOH溶液滴到10mL时,溶液中c(HX)≈c(X-),即Ka(HX)≈c(H+)=10-pH,由于pH>4,则Ka(HX)<10-4,故B错误;
C、V(NaOH)=20mL时,HY与氢氧化钠恰好完全反应生成NaY,HY为弱电解质,Y-水解溶液显示碱性,c(OH-)>c(H+),故C错误;
D、V(NaOH)=15mL时,HZ有一部分与氢氧化钠反应,PH=1判断为强酸,HZ为强电解质溶液显酸性且存在水的电离平衡,溶液中氢离子浓度大于钠离子浓度,浓度关系为:c(Z-)>c(H+)>c(Na+)>c(OH-),故D正确;
故选D.
点评 本题考查了酸碱混合时的定性判断及有关pH的计算,题目难度中等,根据图象数据判断电解质强弱是解题关键,注意掌握根据溶液pH判断电解质强弱的方法.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
15.在大多数有机物分子里,碳原子和碳原子、碳原子和其他原子间相结合的化学键是( )
| A. | 既是离子键、又有非极性共价键 | |
| B. | 既有极性共价键,又有非极性共价键 | |
| C. | 都是非极性共价 | |
| D. | 都是极性共价键 |
12.用一种试剂区别,苯、苯酚溶液、CCl4、己烯四种无色液体,最好选用( )
| A. | 溴水 | B. | FeCl3溶液 | C. | 高锰酸钾溶液 | D. | 水 |
19.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则m克它的氧化物中所含质子的物质的量是( )
| A. | mol | B. | mol | C. | (A-n+2)mol | D. | (A-n+6)mol |
9.下列说法中正确的是( )
| A. | HCl中存在离子键,属于离子化合物 | |
| B. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| C. | 阴阳离子通过静电引力而形成的化学键称为离子键 | |
| D. | 非金属元素组成的化合物中只含共价键 |
12.设NA为阿伏伽德罗常数,下列关于1L0.2mol•L-1的Ba(NO3)2溶液正确的说法是( )
| A. | 2L溶液中阴阳离子总数为0.8NA | |
| B. | 500mL溶液中的Ba2+离子浓度为0.2mol•L-1 | |
| C. | 500mL溶液中的NO3-离子总数为0.2NA | |
| D. | 500mL溶液中的NO3-浓度为0.2mol•L-1 |
13.下列物质中,既不与亚硫酸反应又不与SO2反应的是( )
| A. | H2S | B. | O2 | C. | NaOH | D. | S |

 .
.