题目内容
14.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑩十种元素在周期表中的位置.
请回答:(以下用相应的元素符号回答问题)
(1)在表里填写①~⑩元素符号,写出元素符号①H、③Mg、⑧Cl.
(2)其中化学性质最不活泼的是He(填元素符号).
(3)在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是NaOH(填化学式).
(4)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H(填元素符号)
(5)元素⑥的氢化物的化学式是NH3.该氢化物与元素⑧的氢化物发生反应的化学方程式为NH3+HCl=NH4Cl
(6)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 (1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He;
(2)稀有气体化学性质最不活泼;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)根据同主族自上而下原子半径增大判断;
(5)元素⑥的氢化物为NH3;⑧的氢化物为氯化氢,氯化氢与氨气反应生成氯化铵;
(6)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al;铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:(1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He,
故答案为:①H、②Na、③Mg、④Al、⑤K、⑥N、⑦F、⑧Cl、⑨Br、⑩He;H;Mg;Cl;
(2)稀有气体He的化学性质最不活泼,
故答案为:He;
(3)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;
(4)同主族自上而下原子半径逐渐增大,故三者的原子半径大小为:K>Na>H,
故答案为:K>Na>H;
(5)元素⑥的氢化物为NH3;⑧为Cl元素,其氢化物为HCl,氯化氢与氨气反应生成氯化铵,反应的化学方程式为:NH3+HCl=NH4Cl,
故答案为:NH3;NH3+HCl=NH4Cl;
(6)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al,其氧化物为氧化铝,氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 卤素原子半径越大,氢化物越稳定 | |
| B. | 卤素原子半径越大,氢化物越不稳定 | |
| C. | 卤素氢化物稳定性:HF>HCl>HBr>HI | |
| D. | 卤族单质与氢气越难反应,生成的氢化物越不稳定 |
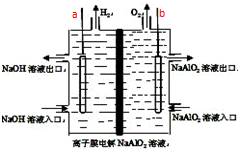 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
| A. | O2、I2、Hg | B. | 铝硅合金、铝、金刚石 | ||
| C. | Na、K、Rb | D. | SiC、金属钠、SO2 |
| A. | CH4+2O2→CO2+2H2O | B. | 2CH3CH2OH+O2→2CH3CHO+2H2O | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | CH2=CH2+Br2→CH2Br-CH2Br |
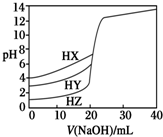 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |