题目内容
12.设NA为阿伏伽德罗常数,下列关于1L0.2mol•L-1的Ba(NO3)2溶液正确的说法是( )| A. | 2L溶液中阴阳离子总数为0.8NA | |
| B. | 500mL溶液中的Ba2+离子浓度为0.2mol•L-1 | |
| C. | 500mL溶液中的NO3-离子总数为0.2NA | |
| D. | 500mL溶液中的NO3-浓度为0.2mol•L-1 |
分析 A、求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含3mol离子;
B、离子的浓度与溶液的体积无关;
C、求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含2molNO3-;
D、离子的浓度与溶液的体积无关.
解答 解:A、2L溶液中Ba(NO3)2的物质的量n=CV=0.2mol/L×2L=0.4mol,而1molBa(NO3)2中含3mol离子,故0.4molBa(NO3)2中含1.2mol离子,故A错误;
B、离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中Ba2+的浓度为0.2mol/L,故B正确;
C、500mlBa(NO3)2的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1molBa(NO3)2中含2molNO3-,故0.1molBa(NO3)2中含0.2molNO3-,故C正确;
D、离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中NO3-的浓度为0.4mol/L,故D错误;
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列各反应属于加成反应的是( )
| A. | CH4+2O2→CO2+2H2O | B. | 2CH3CH2OH+O2→2CH3CHO+2H2O | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | CH2=CH2+Br2→CH2Br-CH2Br |
4.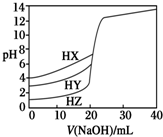 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |
7.Na2O和Na2O2的下列叙述中正确的是( )
| A. | Na2O比Na2O2稳定 | B. | 均可与水反应生成氧气 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
4.下面实验操作可以实现实验目的是(填序号) ( )
| A. | 用铝块与氧化铁粉末充分混和进行铝热反应 | |
| B. | 取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖 | |
| C. | 用稀硝酸清洗做过银镜反应实验的试管 | |
| D. | 在苯中加入溴水,充分振荡静置,观察现象,判断苯环中的碳碳键是否存在碳碳双键 |
1.下列说法正确的是( )
| A. | 水的电离方程式:H2O═H++OH- | B. | 升高温度,水的电离程度增大 | ||
| C. | 在NaOH溶液中没有H+ | D. | 在HCl溶液中没有OH- |