题目内容
19.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则m克它的氧化物中所含质子的物质的量是( )| A. | $\frac{(A-n+8)m}{A+16}$mol | B. | $\frac{(A-n+10)m}{A+16}$ mol | C. | (A-n+2)mol | D. | (A-n+6)mol |
分析 核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,该离子的相对原子质量在数值上等于其质量数;该离子带2个单位正电荷,所以其氧化物的化学式为RO;该氧化物的摩尔质量为(A+16)g/mol,根据n=$\frac{m}{M}$计算mg该氧化物的物质的量,一个氧化物分子中含有(A-N+8)个质子,据此计算.
解答 解:该氧化物的摩尔质量为(A+16)g/mol,n g 它的氧化物的物质的量为$\frac{mg}{(A+16)g/mol}$;
一个氧化物分子中含有(A-N+8)个质子,所以ng 它的氧化物中所含质子的物质的量为$\frac{mg}{(A+16)g/mol}$×(A-N+8)=$\frac{m}{A+16}$(A-N+8)mol,
故选A.
点评 本题考查了质子数、中子数、质量数之间的关系,难度不大,注意质量数在数值上等于其相对原子质量.

练习册系列答案
相关题目
10.由水制氢气,下列研究方向中不正确的是( )
| A. | 构成水的氢气和氧气都是可燃物,因此可研究在水不分解的情况下,使氢气成为二级能源 | |
| B. | 使太阳能聚焦,产生高温,使水分解生成氢气和氧气 | |
| C. | 研究特殊化学物质,开发廉价能源以分解水制取氢气 | |
| D. | 研究高效催化剂,使水分解产生氢气,同时释放能量 |
7.如表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
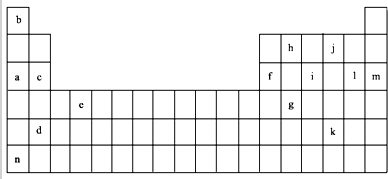
(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成稳定结构,再失去1个电子很困难.
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式 .
.
(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.

(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式
 .
.(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.
14.下列说法中错误的是( )
| A. | 放热反应的反应物总能量,高于生成物的总能量 | |
| B. | 需加热或点燃才发生的反应必为吸热反应 | |
| C. | 酸与碱的中和反应是放热反应 | |
| D. | 焦炭在高温下与水蒸气的反应是吸热反应 |
4.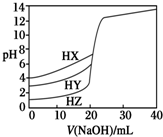 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |
11.下列判断错误的是( )
| A. | 沸点:HI>HBr>HCl>HF | |
| B. | 稳定性:NH3>PH3>AsH3(As与N位于同一主族) | |
| C. | 酸性:HClO4>H2SO4>H3PO4 | |
| D. | 碱性:NaOH>Mg(OH)2>Be(OH)2 |
7.Na2O和Na2O2的下列叙述中正确的是( )
| A. | Na2O比Na2O2稳定 | B. | 均可与水反应生成氧气 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
8.下列说法中一定正确的是( )
| A. | pH=7的溶液中性 | B. | pH>7,溶液呈碱性 | ||
| C. | pH=6溶液中[OH-]=1×10-8 mol•L-1 | D. | pH=6溶液中[H+]=1×10-6 mol•L-1 |



