题目内容
15.在大多数有机物分子里,碳原子和碳原子、碳原子和其他原子间相结合的化学键是( )| A. | 既是离子键、又有非极性共价键 | |
| B. | 既有极性共价键,又有非极性共价键 | |
| C. | 都是非极性共价 | |
| D. | 都是极性共价键 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键.
解答 解:在大多数有机物分子里,碳原子和碳原子之间存在非极性共价键、碳原子和其它原子间存在极性共价键,如C-O、C-N等原子之间存在极性共价键,故选B.
点评 本题考查化学键判断,侧重考查基本概念,熟悉有机物结构是解本题关键,注意题干中限制性条件“有机物分子中”,为易错点.

练习册系列答案
相关题目
5.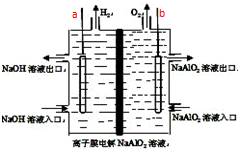 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
3.下列各反应属于加成反应的是( )
| A. | CH4+2O2→CO2+2H2O | B. | 2CH3CH2OH+O2→2CH3CHO+2H2O | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | CH2=CH2+Br2→CH2Br-CH2Br |
10.由水制氢气,下列研究方向中不正确的是( )
| A. | 构成水的氢气和氧气都是可燃物,因此可研究在水不分解的情况下,使氢气成为二级能源 | |
| B. | 使太阳能聚焦,产生高温,使水分解生成氢气和氧气 | |
| C. | 研究特殊化学物质,开发廉价能源以分解水制取氢气 | |
| D. | 研究高效催化剂,使水分解产生氢气,同时释放能量 |
20.只用一种试剂就可以鉴别甲苯、乙醇、苯酚溶液、己烯是( )
| A. | 四氯化碳 | B. | 浓溴水 | C. | 溴的四氯化碳 | D. | 氯化铁溶液 |
7.如表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
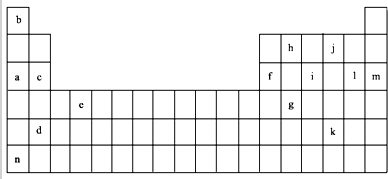
(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成稳定结构,再失去1个电子很困难.
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式 .
.
(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.

(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式
 .
.(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.
4.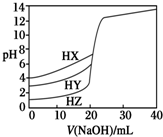 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |
4.下面实验操作可以实现实验目的是(填序号) ( )
| A. | 用铝块与氧化铁粉末充分混和进行铝热反应 | |
| B. | 取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖 | |
| C. | 用稀硝酸清洗做过银镜反应实验的试管 | |
| D. | 在苯中加入溴水,充分振荡静置,观察现象,判断苯环中的碳碳键是否存在碳碳双键 |

