题目内容
16.在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入50mL 0.5mol/L KNO3溶液后,使其中的Fe2+全部氧化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出.(1)推算出x=1,y=1.
(2)配平上述化学方程式,用单线桥标出电子转移的方向和数目
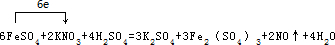 .
.
分析 n(FeSO4)=$\frac{11.4g}{152g/mol}$=0.075mol,KNO3的物质的量为0.05L×0.5mol•L-1=0.025mol,根据氧化剂、还原剂得失电子总数相等计算.
解答 解:(1)n(FeSO4)=$\frac{11.4g}{152g/mol}$=0.075mol,KNO3的物质的量为0.05L×0.5mol•L-1=0.025mol,设NO3-与NxOy中N元素化合价差为a,根据得失电子总数相等的原则,可得关系式:0.075×1=0.025×a,所以a=3即NxOy中N元素化合价为+2价,NxOy为NO,所以x=y=1,故答案为:1;1;
(2)反应生成NO,方程式为6FeSO4+2KNO3+4H2SO4=3K2SO4+3Fe2(SO4)3+2NO↑+4H2O,单线桥标出电子转移的方向和数目可表示为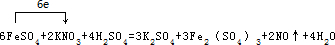 ,故答案为:
,故答案为: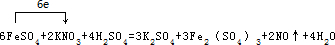 .
.
点评 本题主要考查了氧化还原反应计算,为高频考点,侧重学生的分析、计算能力的考查,明确氧化还原反应规律及基本概念是解题关键,注意得失电子守恒的运用.

练习册系列答案
相关题目
7.如表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
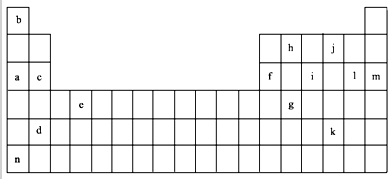
(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成稳定结构,再失去1个电子很困难.
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式 .
.
(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.

(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式
 .
.(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.
4.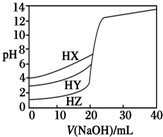 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |
11.下列判断错误的是( )
| A. | 沸点:HI>HBr>HCl>HF | |
| B. | 稳定性:NH3>PH3>AsH3(As与N位于同一主族) | |
| C. | 酸性:HClO4>H2SO4>H3PO4 | |
| D. | 碱性:NaOH>Mg(OH)2>Be(OH)2 |
7.Na2O和Na2O2的下列叙述中正确的是( )
| A. | Na2O比Na2O2稳定 | B. | 均可与水反应生成氧气 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
4.下面实验操作可以实现实验目的是(填序号) ( )
| A. | 用铝块与氧化铁粉末充分混和进行铝热反应 | |
| B. | 取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖 | |
| C. | 用稀硝酸清洗做过银镜反应实验的试管 | |
| D. | 在苯中加入溴水,充分振荡静置,观察现象,判断苯环中的碳碳键是否存在碳碳双键 |
5.如表有三组物质,每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液).
根据该表回答问题:
(1)第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
(2)不跟第I组所有物质发生反应的,能跟第Ⅲ组中所有物质发生反应的是第II组物质中的NaOH,其化学反应方程式为2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3、2NaOH+H2SO4=Na2SO4+2H2O、2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | Fe | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Zn | NaOH | MgCl2 |
(1)第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
(2)不跟第I组所有物质发生反应的,能跟第Ⅲ组中所有物质发生反应的是第II组物质中的NaOH,其化学反应方程式为2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3、2NaOH+H2SO4=Na2SO4+2H2O、2NaOH+MgCl2=Mg(OH)2↓+2NaCl.