题目内容
9.下列说法中正确的是( )| A. | HCl中存在离子键,属于离子化合物 | |
| B. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| C. | 阴阳离子通过静电引力而形成的化学键称为离子键 | |
| D. | 非金属元素组成的化合物中只含共价键 |
分析 A.HCl分子中H-Cl之间只存在共价键;
B.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键;
C.阴阳离子通过静电作用而形成的化学键称为离子键;
D.非金属元素组成的化合物中可能含有离子键.
解答 解:A.HCl分子中H-Cl之间只存在共价键,属于共价化合物,故A错误;
B.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,含有离子键,所以属于离子化合物,故B正确;
C.阴阳离子通过静电作用而形成的化学键称为离子键,静电作用包含吸引力和排斥力,故C错误;
D.非金属元素组成的化合物中可能含有离子键,如铵盐,故D错误;
故选B.
点评 本题考查化学键和化合物的关系,侧重考查基本概念,根据存在的化学键判断化合物类型,易错选项是CD,注意铵盐中存在的化学键,为易错点.

练习册系列答案
相关题目
20.只用一种试剂就可以鉴别甲苯、乙醇、苯酚溶液、己烯是( )
| A. | 四氯化碳 | B. | 浓溴水 | C. | 溴的四氯化碳 | D. | 氯化铁溶液 |
4.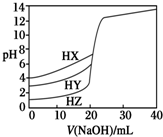 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |
14.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确要经过实验的验证,以下类推的结论正确的是( )
| A. | 由“Cl2+H2O═HCl+HClO”可推出“Br2+H2O═HBr+HBrO”也能发生 | |
| B. | Na与水反应生成NaOH和H2,故所有碱金属与水反应都能生成对应的碱和H2 | |
| C. | HCl的水溶液是强酸,推出HF的水溶液也是强酸 | |
| D. | 由“2Fe+3Cl2═2FeCl3”反应可推出“2Fe+3I2═2FeI3”反应也能发生 |
18.一下气体因与人体血液中的血红蛋白作用引起中毒的是( )
| A. | NO | B. | CO | C. | NO2 | D. | CO2 |