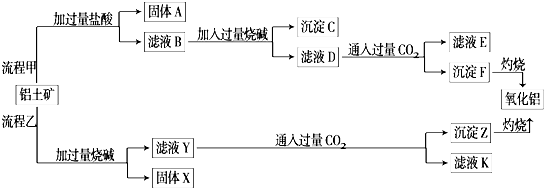
题目内容
12.今年是门捷列夫诞辰181周年,下列事实不能用元素周期律解释的只有( )| A. | 碱性:KOH>NaOH | B. | 相对原子质量:Ar>K | ||
| C. | 酸性HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
分析 A.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
B.相对原子质量的大小与原子序数有关;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.同周期元素从左到右,元素的金属性逐渐减弱.
解答 解:A.Na、K位于周期表相同周期,金属性K>Na,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,能用元素周期律解释,故A不选;
B.相对原子质量的大小与原子序数有关,不能用元素周期律解释,故B选;
C.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,能用元素周期律解释,故C不选;
D.同周期元素从左到右,元素的金属性逐渐减弱,能用元素周期律解释,故D不选.
故选:B.
点评 本题侧重于元素周期律的理解与应用的考查,注意把握元素周期律的递变规律以及相关知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)?N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是( )
| A. | 只要使用合理的催化剂及载体,就可完全清除NO和CO | |
| B. | 使用催化剂只能改变反应的速率不能改变反应的平衡常数 | |
| C. | 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) | |
| D. | 恒容条件下,通入惰性气体可提高NO转化率 |
20.将Fe、FeO和Fe2O3的混合物m g加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08mol,放出的气体在标准状况下的体积为0.224L,则原混合物中氧元素的质量分数为( )
| A. | 20.5% | B. | 18.6% | C. | 17.6% | D. | 无法计算 |
7.某离子化合物的晶体中,最小重复单元及其八分之一结构单元如图所示,具有该晶体结构的化合物可能是( )


| A. | CaF2 | B. | CO2 | C. | NaCl | D. | CsCl |
17.以NA表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 1 mol NH3分子中含有3NA个σ键和4NA个sp3杂化轨道 | |
| B. | 1 mol CO2分子中含有2NA个σ键和2NA个sp2杂化轨道 | |
| C. | 1 mol C2H2分子中含有2NA个σ键、2NA个π键 | |
| D. | 1 mol C2H4分子中含有4NA个σ键、2NA个π键 |
4.下列可构成原电池装置的是( )
| A. |  | B. | 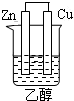 | C. |  | D. | 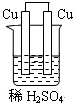 |
1.下列物质沸点的比较,错误的是( )
| A. | 丙烷>乙烷 | B. | 丁烷>乙醇 | C. | 苯酚>苯 | D. | 1-氯丙烷>丙烷 |
2.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |