题目内容
2.下列实验能获得成功的是( )| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |
分析 A.苯和液溴在铁作催化剂条件下制备溴苯;
B.甲烷和氯气在光照条件下发生取代反应生成多种氯代烃,且同时生成HCl;
C.碳化钙和食盐水反应生成乙炔;
D.苯和浓硝酸在浓硫酸作催化剂条件下加热制备硝基苯.
解答 解:A.苯和液溴在铁作催化剂条件下制备溴苯,和浓溴水不反应,故A错误;
B.甲烷和氯气在光照条件下发生取代反应生成多种氯代烃,且同时生成HCl,生成物为混合物,故B错误;
C.碳化钙和食盐水反应生成乙炔,食盐水代替水能减缓反应速率,故C正确;
D.苯和浓硝酸在浓硫酸作催化剂条件下加热制备硝基苯,没有浓硫酸作催化剂不能实现实验目的,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理、实验条件等是解本题关键,会从实验条件、实验原理等方面进行评价,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.今年是门捷列夫诞辰181周年,下列事实不能用元素周期律解释的只有( )
| A. | 碱性:KOH>NaOH | B. | 相对原子质量:Ar>K | ||
| C. | 酸性HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
10.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
14.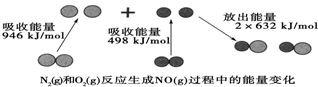 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量大于2mol NO(g)具有的总能量 |
11.下列化合物分子中,在核磁共振氢谱图中能给出二种信号的是( )
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
12.在雾霾天气的大气中能检测到多种有毒含氮化合物,如过氧乙酰基硝酸酯(PAN).大气中的烃类和NO2经过一系列光解反应生成过氧乙酰基,再与NO2化合形成PAN.该反应过程如下:

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 夏季气温高,PAN含量高 | |
| B. | 气压低,化学平衡常数增大,PAN含量高 | |
| C. | 减少氮氧化物的排放可以减少PAN的含量 | |
| D. | 大气中灰尘可起催化作用,能提高过氧乙酰基的转化率 |



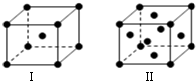 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.