题目内容
3.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: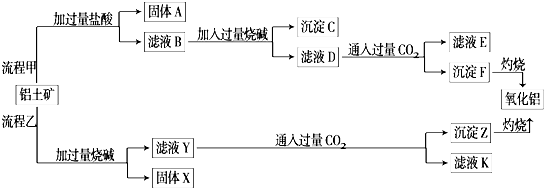
请回答下列问题:
(1)流程甲中D溶液中通入过量的CO2的离子方程式为AlO2-+2H2O+CO2═Al(OH)3↓+HCO3ˉ.
(2)流程乙加入烧碱后生成SiO32-的离子方程式为SiO2+2OH-═SiO32-+H2O.
(3)验证滤液B含Fe3+,可取少量滤液并加入硫氰化钾(填试剂名称).
(4)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+.回答下列问题:
①写出锌和氢氧化钠溶液反应的化学方程式:Zn+2NaOH═Na2ZnO2+H2↑.
②下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是ACD.
A.硫酸铝和氢氧化钠 B.硫酸铝和氨水 C.硫酸锌和氢氧化钠 D.硫酸锌和氨水
③试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成[Zn(NH3)4]2+,氨水的用量不易控制.
分析 铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中加入稀盐酸,Al2O3、Fe2O3、MgO分别和稀盐酸反应生成AlCl3、FeCl3、MgCl2,SiO2不溶于稀盐酸,然后过滤得到的A为SiO2,向滤液B中加入过量烧碱,AlCl3、FeCl3、MgCl2分别和NaOH反应生成可溶性的NaAlO2和沉淀Fe(OH)3、Mg(OH)2,然后再过滤,向滤液中通入过量二氧化碳,生成Al(OH)3沉淀同时生成可溶性NaHCO3,再过滤,滤液E中溶质成分是NaHCO3,沉淀F是Al(OH)3,将沉淀F灼烧得到氧化铝;
铝土矿中加入过量NaOH溶液,Al2O3、SiO2溶于氢氧化钠分别得到可溶性的NaAlO2、Na2SiO3,Fe2O3、MgO不溶于NaOH溶液,然后过滤得到固体X为Fe2O3、MgO,滤液Y中含有NaOH、NaAlO2、Na2SiO3,向滤液中通入过量二氧化碳,得到沉淀Z为Al(OH)3、H2SiO3,滤液中K为NaHCO3,灼烧氢氧化铝和硅酸分别得到氧化铝和二氧化硅;
(1)流程甲中D溶液中通入过量的CO2生成碳酸氢钠和氢氧化铝;
(2)二氧化硅和NaOH反应生成硅酸钠和水;
(3)铁离子和KSCN溶液反应生成络合物而使溶液呈血红色;
(4)①锌和氢氧化钠溶液反应生成偏锌酸钠和氢气;
②两种溶液,用相互滴加的实验方法即可鉴别说明其反应现象不同;
③氢氧化锌能溶于过量氨水中.
解答 解:铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中加入稀盐酸,Al2O3、Fe2O3、MgO分别和稀盐酸反应生成AlCl3、FeCl3、MgCl2,SiO2不溶于稀盐酸,然后过滤得到的A为SiO2,向滤液B中加入过量烧碱,AlCl3、FeCl3、MgCl2分别和NaOH反应生成可溶性的NaAlO2和沉淀Fe(OH)3、Mg(OH)2,然后再过滤,向滤液中通入过量二氧化碳,生成Al(OH)3沉淀同时生成可溶性NaHCO3,再过滤,滤液E中溶质成分是NaHCO3,沉淀F是Al(OH)3,将沉淀F灼烧得到氧化铝;
铝土矿中加入过量NaOH溶液,Al2O3、SiO2溶于氢氧化钠分别得到可溶性的NaAlO2、Na2SiO3,Fe2O3、MgO不溶于NaOH溶液,然后过滤得到固体X为Fe2O3、MgO,滤液Y中含有NaOH、NaAlO2、Na2SiO3,向滤液中通入过量二氧化碳,得到沉淀Z为Al(OH)3、H2SiO3,滤液中K为NaHCO3,灼烧氢氧化铝和硅酸分别得到氧化铝和二氧化硅;
(1)流程甲中D溶液中通入过量的CO2生成碳酸氢钠和氢氧化铝,离子方程式为AlO2-+2H2O+CO2═Al(OH)3↓+HCO3ˉ,故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3ˉ;
(2)二氧化硅和NaOH反应生成硅酸钠和水,离子反应方程式为SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(3)铁离子和KSCN溶液反应生成络合物而使溶液呈血红色,所以可以用KSCN溶液检验铁离子,故答案为:硫氰化钾;
(4)①锌和氢氧化钠溶液反应生成偏锌酸钠和氢气,反应方程式为Zn+2NaOH═Na2ZnO2+H2↑,故答案为:Zn+2NaOH═Na2ZnO2+H2↑;
②两种溶液,用相互滴加的实验方法即可鉴别说明其反应现象不同,
A.向硫酸铝中加入NaOH溶液,先生成沉淀后沉淀溶解,向氢氧化钠溶液中加入硫酸铝溶液,先没有沉淀生成后产生沉淀,所以现象不同,可以鉴别,故A正确;
B.硫酸铝、氨水相互滴加都生成白色沉淀,所以无法鉴别,故B错误;
C.向硫酸锌溶液中加入NaOH溶液先生成白色沉淀后沉淀溶解,向氢氧化钠中加入硫酸锌溶液,先没有沉淀生成后产生沉淀,所以现象不同,可以鉴别,故C正确;
D.向硫酸锌溶液中加入氨水溶液先生成白色沉淀后沉淀溶解,向氨水中加入硫酸锌溶液,先没有沉淀生成后产生沉淀,所以现象不同,可以鉴别,故D正确;
故选ACD;
③可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成[Zn(NH3)4]2+,氨水的用量不易控制,所以不能用硫酸锌和氨水制取氢氧化锌,故答案为:可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成[Zn(NH3)4]2+,氨水的用量不易控制.
点评 本题考查物质的分离和提纯,为高频考点,侧重考查学生分析推断、知识迁移能力,明确元素化合物性质是解本题关键,知道流程图中发生的反应及操作方法,注意氢氧化锌能溶于氨水,题目难度不大.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案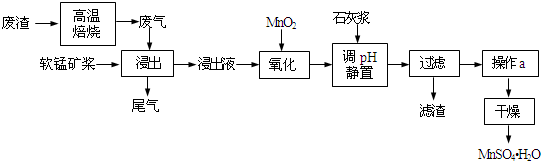
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO溶液制备HClO |
| A. | A | B. | B | C. | C | D. | D |
(1)早期冶炼金属锰的一种方法是先缎烧软锰矿生成Mn304,再利用铝热反应原理由Mn3O4制备锰.该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn
(2)现代冶炼金属锰的一种工艺流程如图所示:

下表t℃时,有关物质的pKap(注pKap=-1Kap).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKap | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“=”)MnS04浸出液的pH.
③加入MnF2的目的是除去Ca2+(填“Ca2+”“Fe3+”或“Cu2+”).
(3)由MnS04制取MnC03.往MnS04溶液中加人NH4HC03溶液,析出MnC03沉淀并逸出C02气体,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnS04溶液中加人(NH4)2C03溶液,还会产生Mn(OH) 2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,该反应的平衡常数K=100(填数值).
| A. | 物质的量相等的185Hf与180Hf质量相同 | |
| B. | 核外电子数分别为108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子数少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
| A. | 碱性:KOH>NaOH | B. | 相对原子质量:Ar>K | ||
| C. | 酸性HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |