题目内容
7.某离子化合物的晶体中,最小重复单元及其八分之一结构单元如图所示,具有该晶体结构的化合物可能是( )
| A. | CaF2 | B. | CO2 | C. | NaCl | D. | CsCl |
分析 阴离子位于晶胞的体内,共8个,阳离子位于晶胞的顶点和面心,晶胞中B的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则阳离子与阴离子的离子个数为4:8=1:2,结合选项中各物质阳离子与阴离子数目之比判断.
解答 解:阴离子位于晶胞的体内,共8个,阳离子位于晶胞的顶点和面心,晶胞中B的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则阳离子与阴离子的离子个数为4:8=1:2,
A.CaF2由钙离子与氟离子构成,二者数目之比为1:2,故A符合;
B.CO2是分子晶体,不属于离子化合物,故B不符合;
C.NaCl中阴阳离子个数比为1:1,故C不符合;
D.CsCl中阴阳离子个数比为1:1,故D不符合,
故选A.
点评 本题考查晶胞的计算,题目难度不大,注意均摊法的应用,注意选项中各物质的构成微粒.

练习册系列答案
 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.我国科学家首次合成的一种过渡金属的新核素${\;}_{72}^{185}$Hf,具有延展性,不易被腐蚀,可应用于高科技领域等特点.185Hf可由180Hf转化而成,下列有关180Hf、185Hf的说法正确的是( )
| A. | 物质的量相等的185Hf与180Hf质量相同 | |
| B. | 核外电子数分别为108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子数少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
2.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择不正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 渗析 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | 肥皂(甘油) | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
12.今年是门捷列夫诞辰181周年,下列事实不能用元素周期律解释的只有( )
| A. | 碱性:KOH>NaOH | B. | 相对原子质量:Ar>K | ||
| C. | 酸性HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
19.上海自主研发了一种氢燃料汽车.它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )
| A. | 正极反应:O2+2H2O+4e-═4OH- | |
| B. | 当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) | |
| C. | 发生氧化反应的是负极 | |
| D. | 氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
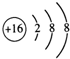 .
.
