题目内容
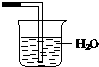
4.下列可构成原电池装置的是( )| A. |  | B. |  | C. |  | D. |  |
分析 原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
A.该装置符合原电池构成条件,所以能形成原电池,且Zn易失电子作负极、Cu作正极,故A正确;
B.该装置不能自发进行氧化还原反应,所以不能构成原电池,故B错误;
C.该装置没有形成闭合回路,所以不能构成原电池,故C错误;
D.该装置电极材料相同且不能自发进行氧化还原反应,所以不能构成原电池,故D错误;
故选A.
点评 本题考查原电池构成条件,明确原电池原理是解本题关键,这几个条件必须同时具备才能构成原电池,缺一不可.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
15.我国科学家首次合成的一种过渡金属的新核素${\;}_{72}^{185}$Hf,具有延展性,不易被腐蚀,可应用于高科技领域等特点.185Hf可由180Hf转化而成,下列有关180Hf、185Hf的说法正确的是( )
| A. | 物质的量相等的185Hf与180Hf质量相同 | |
| B. | 核外电子数分别为108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子数少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
12.今年是门捷列夫诞辰181周年,下列事实不能用元素周期律解释的只有( )
| A. | 碱性:KOH>NaOH | B. | 相对原子质量:Ar>K | ||
| C. | 酸性HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
19.上海自主研发了一种氢燃料汽车.它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )
| A. | 正极反应:O2+2H2O+4e-═4OH- | |
| B. | 当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) | |
| C. | 发生氧化反应的是负极 | |
| D. | 氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
9.根据元素的核电荷数,不能确定的是( )
| A. | 原子核内质子数 | B. | 原子核中子数 | ||
| C. | 原子核外的最外层电子数 | D. | 原子的电子数 |
16.AgCl(s)?Ag++Cl-,平衡时[Ag+][Cl-]=Ksp,过量氯化银分别投入①100mL水 ②24mL0.1mol•L-1NaCl ③10mL 0.1mol•L-1MgCl2 ④30mL 0.1mol•L-1AgNO3溶液中,溶液中[Ag+]从大到小顺序( )
| A. | ③①②④ | B. | ④①②③ | C. | ①②③④ | D. | ④③②① |
14.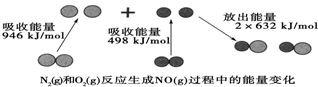 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为1mol N2(g)和1mol O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量大于2mol NO(g)具有的总能量 |