题目内容
17.有关反应5Cu+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+3CuSO4+4H2O的叙述正确的是( )| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 每有1 mol Cu参加反应时转移2 mol e- | |
| C. | 氧化产物只有CuSO4 | |
| D. | 浓硫酸既是氧化剂又是还原剂 |
分析 反应5Cu+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+3CuSO4+4H2O中,Cu元素化合价由0价分别升高到+1价、+2价,S元素化合价由+6价降低到-2价,以此解答该题.
解答 解:A.反应中Cu元素化合价降低,Cu为还原剂,S元素化合价降低生成Cu2S,由方程式可知氧化剂与还原剂的物质的量之比为1:5,故A正确;
B.由方程式可知5molCu参加反应转移8mol电子,则1molCu参加反应转移$\frac{8}{5}$mol电子,故B错误;
C.Cu元素化合价由0价分别升高到+1价、+2价,氧化产物有Cu2S、CuSO4,故C错误;
D.浓硫酸在反应中化合价部分降低,起到酸性和氧化剂的作用,故D错误.
故选A.
点评 本题考查氧化还原反应,题目难度中等,解答该题的关键是正确判断各元素的化合价的变化,能从化合价的角度进行判断和计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.纪录片《舌尖上的中国》展示了中华饮食文化的博大精深.下列烹饪用品的调味成分不属于有机物的是( )
| A. | 食盐 | B. | 香醋 | C. | 植物油 | D. | 黄酒 |
5.下列有关除杂质(括号内物质为杂质)的方法中,错误的是( )
| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
12.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
A~E中,属于烃的是AB(填字母).
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为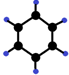 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
A~E中,属于烃的是AB(填字母).
A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
有机物B具有的性质是②③(填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
2.下列相关反应的离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
6.下列化学反应,属于加成反应的是( )
| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 甲烷与氯气在光照条件下发生反应 |
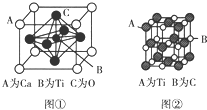 钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.