题目内容
10.纪录片《舌尖上的中国》展示了中华饮食文化的博大精深.下列烹饪用品的调味成分不属于有机物的是( )| A. | 食盐 | B. | 香醋 | C. | 植物油 | D. | 黄酒 |
分析 有机物是指含有碳元素的化合物.无机物是指不含有碳元素的化合物.一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物.
解答 解:A.食盐不含碳元素,属于无机物,故A正确;
B.香醋的主要成分是乙酸,是含有碳元素的化合物,属于有机物,故B错误;
C.植物油的主要成分是油脂,是含有碳元素的化合物,属于有机物,故C错误;
D.黄酒的主要成分是酒精,含有碳元素的化合物,属于有机物,故D错误.
故选A.
点评 本题考查无机化合物与有机化合物的概念,难度不大,解答本题要掌握有机物和无机物的区别与联系方面的知识,只有这样才能对各种物质进行正确的分类.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
18.某有机物结构简式如图,该有机物不可能具有的性质是( )
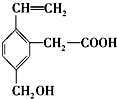

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 能发生酯化反应 | |
| C. | 能在铜作催化剂的条件下发生催化氧化 | |
| D. | 能与4mol溴单质发生加成反应 |
2.以下互为同位素的是( )
| A. | 金刚石与石墨 | B. | D2与H2 | ||
| C. | CO与CO2 | D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl |
16.过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.请回答相关问题:
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
i.实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2较稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
计算试样中过氧化氢的浓度为0.18mol•L-1.
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
17.有关反应5Cu+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+3CuSO4+4H2O的叙述正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 每有1 mol Cu参加反应时转移2 mol e- | |
| C. | 氧化产物只有CuSO4 | |
| D. | 浓硫酸既是氧化剂又是还原剂 |
 1
1 下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证: .(其它无机物任选)
.(其它无机物任选)