题目内容
4. 钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.(1)请写出铝原子的基态电子排布式:1s22s22p63s23p1.
(2)X+、Y2-、Z-与Al3+具有相同的电子层结构,则下列说法正确的是BD.
A.元素第一电离能:X>Al
B.电负性:Z>Y
C.氢化物稳定性:H2Y>HZ
D.H2Y中Y的杂化类型是sp3,键角小于109.5°
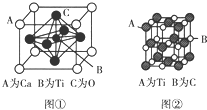
(3)某钙钛型复合氧化物晶胞结构如图①所示,以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有磁电阻效应.该钙钛型复合氧化物的化学式为CaTiO3.
(4)最近发现钛(Ti)原子和碳原子可构成气态团簇分子,分子模型如图②所示.该气态团簇分子的分子式为Ti14C13,它属于分子晶体,其主要物理性质有熔沸点低、硬度较小(写出两点即可).
分析 (1)根据铝为13号元素,核外有13个电子书写原子的基态电子排布式;
(2)根据X+、Y2-、Z-与Al3+具有相同的电子层结构,所以X是钠、Y是氧、Z是氟,
A、同周期元素第一电离能整体增大,但第ⅡAⅤA由于处于半满和全满的稳定结构反常,据此分析;
B、根据F的非金属性大于O分析;
C、根据F的非金属性大于O分析;
D、在水分子中,氧以sp3杂化形式与氢原子结合,且由于存在两对孤对电子,对成键原子间的共价键有排斥作用,键角小于109.5°;
(3)根据均摊法计算晶胞中Ca、Ti、O原子数目,进而确定化学式;
(4)气态团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,只需数出该结构中两种原子的数目就可以了,据此分析.
解答 解:(1)铝为13号元素,核外有13个电子,则原子的基态电子排布式为1s22s22p63s23p1.,故答案为:1s22s22p63s23p1;
(2)因为X+、Y2-、Z-与Al3+具有相同的电子层结构,所以X是钠、Y是氧、Z是氟,
A、元素第一电离能应为Al>Na,故A错误;
B、因为F的非金属性大于O,所以电负性F>O,故B正确;
C、因为F的非金属性大于O,所以氢化物稳定性应为HF>H2O,故C错误;
D、在水分子中,氧以sp3杂化形式与氢原子结合,且由于存在两对孤对电子,对成键原子间的共价键有排斥作用,键角小于109.5°,故D正确;
故选:BD;
(3)利用分摊法计算,晶胞中Ca的个数为8×$\frac{1}{8}$=1,Ti的个数为1,O的个数为6×$\frac{1}{2}$=3,其化学式为CaTiO3,故答案为:CaTiO3;
(4)气态团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,只需数出该结构中两种原子的数目就可以了,所以该气态团簇分子的分子式为Ti14C13,它属于分子晶体,其主要物理性质有熔沸点低、硬度较小;故答案为:Ti14C13;分子; 熔沸点低、硬度较小.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、晶胞计算等,旨在考查学生对基础知识的掌握及综合应用,(4)中注意气态团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,难度中等.

| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 每有1 mol Cu参加反应时转移2 mol e- | |
| C. | 氧化产物只有CuSO4 | |
| D. | 浓硫酸既是氧化剂又是还原剂 |
| A. | 氯化铝溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| B. | 碳酸钙与盐酸反应:CaCO3+2 H+→Ca2++CO2↑+H2O | |
| C. | 锌粉溶解于醋酸:Zn+2 H+→Zn2++H2↑ | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓ |
| A. |  +HNO3$→_{△}^{浓盐酸}$ +HNO3$→_{△}^{浓盐酸}$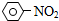 +H2O 取代反应 +H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br CH2Br; 加成反应 | |
| C. | CH3CH2OH+HCl→CH3CH2Cl+H2O; 酯化反应 | |
| D. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O; 氧化反应 |
 ,下列有关木糖醇的叙述中不正确的是( )
,下列有关木糖醇的叙述中不正确的是( )| A. | 1mol木糖醇与足量钠反应最多可产生2.5molH2 | |
| B. | 木糖醇是一种单糖,不能发生水解反应 | |
| C. | 木糖醇易溶解于水,能发生酯化反应 | |
| D. | 糖尿病患者可以食用 |
| A. | 根据一次能源和二次能源的划分,氢气为二次能源 | |
| B. | 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 | |
| C. | 火电是将燃料中的化学能直接转化为电能的过程 | |
| D. | 原电池工作过程中是直接将化学能转化为电能的过程 |
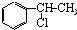 、
、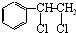 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去.(提示:若同一个碳原子上同时连接两个羟基时,结构很不稳定,会发生分子内脱水.如:)
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去.(提示:若同一个碳原子上同时连接两个羟基时,结构很不稳定,会发生分子内脱水.如:)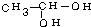 →
→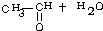
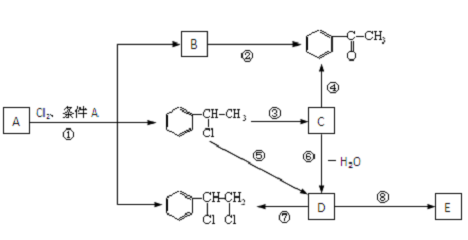
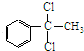
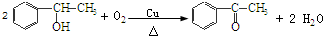 反应⑧:n
反应⑧:n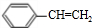 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$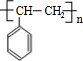 .
.