题目内容
5.下列有关除杂质(括号内物质为杂质)的方法中,错误的是( )| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
分析 A.乙烯被氧化生成二氧化碳气体;
B.Na2CO3可与CO2反应生成NaHCO3;
C.苯不溶于水,溴与氢氧化钠反应;
D.FeCl2可被氯气氧化生成FeCl3.
解答 解:A.乙烯被氧化生成二氧化碳气体,引入新杂质,应用溴水除杂,故A错误;
B.Na2CO3可与CO2反应生成NaHCO3,可用于除杂,故B正确;
C.苯不溶于水,溴与氢氧化钠反应,可用于除杂,故C正确;
D.FeCl2具有还原性,可被氯气氧化生成FeCl3,可用于除杂,故D正确.
故选A.
点评 本题考查混合物分离提纯方法的选择,为高频考点,把握物质的性质及性质差异为解答的关键,注意发生的化学反应及除杂的原则,题目难度不大.

练习册系列答案
相关题目
18.某有机物结构简式如图,该有机物不可能具有的性质是( )
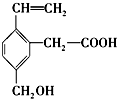

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 能发生酯化反应 | |
| C. | 能在铜作催化剂的条件下发生催化氧化 | |
| D. | 能与4mol溴单质发生加成反应 |
16.过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.请回答相关问题:
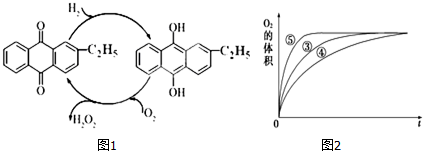
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.
(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
i.实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2较稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
计算试样中过氧化氢的浓度为0.18mol•L-1.
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如图1,此过程的总方程式为H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式H2O2?H++HO2-HO2-?H++O22-.
ii.测定H2O2水溶液pH的方法为D(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图2所示.
分析该图能够得出的实验结论是溶液pH越大,双氧水分解速度越快.
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
2MnO4-+H2O2+H+═2Mn2++H2O+O2↑
i.请配平以上离子方程式2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000mol•L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果偏高(“偏高”或“偏低”或“不变”).
13.下列实验能达到预期目的是( )
| A. | 用酸式滴定管量取20.0mL酸性高锰酸钾溶液 | |
| B. | 用米汤直接检验食盐中是否有碘元素 | |
| C. | 用酚酞检验纯碱中是否含有烧碱 | |
| D. | 多次盐析或多次渗析的方法分离提纯蛋白质 |
20.下列操作能达到预期目的是( )
| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将乙醇与浓的氢溴酸混合加热可以制备溴乙烷 | |
| D. | 做过银镜反应实验的试管内壁附着银,用稀氨水可以洗去 |
10.某原电池总反应的离子方程式为2Fe3++Fe═3 Fe2+,能实现该反应的原电池组成是( )
| A. | 正极为铁,负极为铜,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
17.有关反应5Cu+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S+3CuSO4+4H2O的叙述正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 每有1 mol Cu参加反应时转移2 mol e- | |
| C. | 氧化产物只有CuSO4 | |
| D. | 浓硫酸既是氧化剂又是还原剂 |

 ;G的化学式为Fe(OH)3.
;G的化学式为Fe(OH)3.