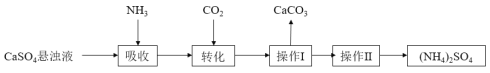
题目内容
【题目】W、X、Y、Z均为短周期元素,X、W可形成两种液态化合物甲和乙,其原子个数比分别为1∶1(甲)和2∶1(乙),且分子中电子总数分别为18(甲)和10(乙)。X与Z能形成一种极易溶于水的碱性气体丙X与Y能形成极易溶于水的酸性气体丁,丁分子中的电子数为18。X、Y、Z能形成一种离子化合物,其水溶液呈弱酸性。请写出:
(1)W的元素符号___,其核外共有___种运动状态不同的电子。
(2)甲物质的结构式为___;乙物质的空间构型为___。
(3)Z元素核外共有___种能量不同的电子,碱性气体甲的电子式为___。
(4)用离子方程式解释X、Y、Z形成的化合物水溶液呈弱酸性的原因是___。
(5)铋元素跟Y元素能形成化合物(BiY3),其水解生成难溶于水的BiOY。
①BiY3水解反应的化学方程式为___。
②把适量的BiY3溶于含有少量丁的水中,能得到澄清溶液,试分析可能的原因___。
③医药上把BiOY叫做“次某酸铋”,分析这种叫法的不合理之处,为什么。___。
【答案】O 8 H-O-O-H V型 3 ![]() NH4++H2O
NH4++H2O![]() NH3·H2O+H+ BiCl3+H2O
NH3·H2O+H+ BiCl3+H2O![]() BiOCl↓+2HCl 盐酸能抑制BiCl3的水解 不合理,因为BiOCl中的Cl的化合价为-1
BiOCl↓+2HCl 盐酸能抑制BiCl3的水解 不合理,因为BiOCl中的Cl的化合价为-1
【解析】
W、X、Y、Z均为短周期元素,X、W可形成两种液态化合物甲和乙,其原子个数比分别为1∶1(甲)和2∶1(乙),且分子中电子总数分别为18(甲)和10(乙),则W为O元素,X为H元素,两种化合物甲为H2O2、乙为H2O;X与Z能形成一种极易溶于水的碱性气体丙,则丙为NH3,Z为N元素;H与Y能形成极易溶于水的酸性气体丁,丁分子中的电子数为18,则丁为HCl,Y为Cl元素;H、Cl、N三种元素能组成一种离子化合物,其水溶液呈弱酸性,则此离子化合物为NH4Cl,据此解题。
由分析知:W为O元素、X为H元素、Y为Cl元素、Z为N元素、甲为H2O2、乙为H2O、丙为NH3;
(1)由分析知W为氧元素,元素符号为O,其原子核外共有8个电子,则共有8种运动状态不同的电子;
(2)甲H2O2,为极性分子,含有H-O和O-O键,则结构式为H-O-O-H;乙为H2O,O原子的杂化轨道形式为sp3,有两个孤对电子,则空间构型为V型;
(3)Z为N元素,电子排布式为1s22s22p3,同一轨道上的电子能量相等,则核外共有3种能量不同的电子,碱性气体丙为NH3,其电子式为![]() ;
;
(4)H、Cl、N三种元素组成的离子化合物为NH4Cl,在水溶液中NH4+的水解,使溶液呈弱酸性,发生水解反应的离子方程式为NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(5)铋元素跟Cl元素能形成化合物为BiCl3,其水解生成难溶于水的BiOCl;
①BiCl3水解生成难溶于水的BiOCl,则另一种产物为HCl,水解反应的化学方程式为BiCl3+H2O![]() BiOCl↓+2HCl;
BiOCl↓+2HCl;
②BiCl3溶于稀盐酸,盐酸抑制了BiCl3的水解,从而得到澄清溶液;
③BiOCl中Cl元素的化合价为-1价,而次氯酸中Cl元素为+1价,则BiOCl叫做“次某酸铋”的说法不合理。