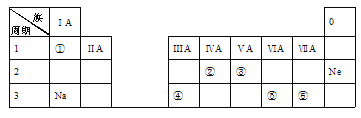
题目内容
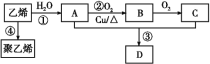
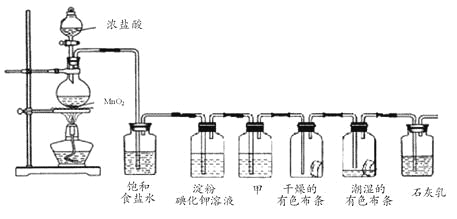
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验:
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是________________,反应的离子方程式为_____________。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放________(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为___________________________。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2____L。
【答案】溶液变蓝色 Cl2+2I- =2Cl- +I2 浓硫酸 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2.24
【解析】
(1)浓盐酸与二氧化锰加热反应产生氯气,氯气与KI发生置换反应生成单质碘,碘遇淀粉变蓝色,所以淀粉碘化钾溶液中观察到的现象是溶液变蓝色;,反应的离子方程式是Cl2+2I- =2Cl- +I2;
(2)甲的作用是干燥氯气,所以甲中的试剂是浓硫酸;
(3)氯气与氢氧化钙溶液反应生成氯化钙、次氯酸钙、水,制取漂白粉,化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)8.7g二氧化锰的物质的量是0.1mol,根据MnO2+4HCl(浓)![]() MnCl2+ Cl2↑+2 H2O,可知0.1mol二氧化锰完全反应,最多生成0.1mol氯气,标准状况下的体积为0.1mol×22.4L/mol=2.24L。
MnCl2+ Cl2↑+2 H2O,可知0.1mol二氧化锰完全反应,最多生成0.1mol氯气,标准状况下的体积为0.1mol×22.4L/mol=2.24L。

 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置或操作 | 取两支试管各加入4 mL 0.01 mol/L的草酸溶液,分别滴加2 mL 0.1 mol/L、0.2 mol/L的高锰酸钾溶液 |
|
| 向分别盛有5 mL 0.1 mol/L的硫代硫酸钠溶液的试管中滴加5 mL 0.1 mo/L的硫酸溶液,一段时间后,分别放在冷水和热水中。 |
现象 | 褪色并观察褪色的时间 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊且热水中首先出现浑浊 |
结论 | 其他条件不变时,反应物浓度越大,反应速率越快 | 氧化性:Cl2>Br2>I2 | 溶解度:AgCl>AgBr>AgI | 不能说明温度越高,速率越快 |
A.AB.BC.CD.D