题目内容
【题目】碳和硅均为元素周期表中第IV A族的元素,其单质和化合物有着重要应用。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式________。石墨烯中C的杂化类型为________。
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为________mol。

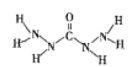
③石墨烯加氢制得的石墨烷,可用![]() 表示。下列有关叙述正确的是________。
表示。下列有关叙述正确的是________。
a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
④石墨烯可由加热![]() 晶体脱除
晶体脱除![]() 的方法制得。该过程属于________。
的方法制得。该过程属于________。
a.物理变化 b.分解反应 c.氧化还原反应
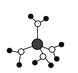
(2)![]() 的晶体结构与晶体硅类似。
的晶体结构与晶体硅类似。![]() 的晶体类型为________,晶体中
的晶体类型为________,晶体中![]() 原子与
原子与![]() 键的数目之比为________。
键的数目之比为________。
(3)![]() 与
与![]() 空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
【答案】1s22s22p2 sp2杂化 0.5 b b、c 原子晶体 1:4 SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑
【解析】
(1)①碳原子的核电荷数为6,其原子结构示意图为![]() ;C与相邻C形成3个C-C键,没有孤对电子;
;C与相邻C形成3个C-C键,没有孤对电子;
②石墨烯中每个碳原子形成3个碳碳键,每个碳碳键为2个碳原子共用。每个碳原子为3个六元环共用,1个六元环含有2个碳原子;
③结合烷烃和烯烃的结构特点和性质分析;
④加热![]() 晶体脱除
晶体脱除![]() 制得石墨烯,反应过程中引入碳碳双键,且C元素的化合价发生改变;
制得石墨烯,反应过程中引入碳碳双键,且C元素的化合价发生改变;
(2)晶体硅为原子晶体;晶体中每个Si原子形成4个Si-C键;
(3)SiHCl3与水剧烈反应,生成的两种酸应该是H2SiO3和HCl,结合元素的化合价升降,同时生成的气体为H2。
(1)①碳原子的核电荷数为6,其原子结构示意图为![]() ,则基态碳原子的电子排布式为1s22s22p2;C与相邻C形成3个C-C键,没有孤对电子,杂化方式均为sp2;
,则基态碳原子的电子排布式为1s22s22p2;C与相邻C形成3个C-C键,没有孤对电子,杂化方式均为sp2;
②每个碳原子形成3个碳碳键,每个碳碳键为2个碳原子共用,故每碳原子单占有的共价键为![]() =1.5,则碳原子和碳碳键的个数比是1:1.5=2:3,每个碳原子为3个六元环共用,1个六元环含有2个碳原子,12g碳的物质的量为1mol,则六元环物质的量为0.5mol;
=1.5,则碳原子和碳碳键的个数比是1:1.5=2:3,每个碳原子为3个六元环共用,1个六元环含有2个碳原子,12g碳的物质的量为1mol,则六元环物质的量为0.5mol;
③a.石墨烷的分子通式为(CH)n,不满足烷烃的分子通式CnH2n+2,则不属于烷烃,故a错误;
b.石墨烷属烃类,均难溶于水,故b正确;
c.石墨烷中所有碳原子均为sp3杂化,则所有碳原子不可能共平面,故c错误;
d.石墨烷中不存在碳碳双键,不可以发生加成反应,故d错误;
故答案为b;
④a.加热![]() 晶体脱除
晶体脱除![]() 制得石墨烯,有新物质生成,是化学变化,故a错误;
制得石墨烯,有新物质生成,是化学变化,故a错误;
b.加热![]() 晶体脱除
晶体脱除![]() 制得石墨烯,发生反应的化学方程式为SiC=Si+C,属分解反应,故b正确;
制得石墨烯,发生反应的化学方程式为SiC=Si+C,属分解反应,故b正确;
c.反应中碳、硅元素化合价发生变化,属于氧化还原反应,故c正确;
故答案为b、c;
(2)晶体硅为原子晶体,SiC的晶体结构与晶体硅类似,则SiC的晶体类型为原子晶体;晶体中每个Si原子形成4个Si-C键,则晶体中Si原子与Si-C键的数目之比为1:4;
(3)SiHCl3与水剧烈反应,生成的两种酸应该是H2SiO3和HCl,结合元素的化合价升降,同时生成的气体为H2,该反应的化学方程式为SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑。

【题目】 X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(1)元素X在元素周期表中的位置是_______。
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是_________,所含化学键的类型有离子键、____
(3)Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为________
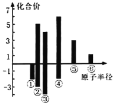
(4)上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为_______
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是_____,发生反应的离子方程式是_____________