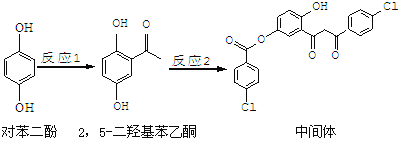
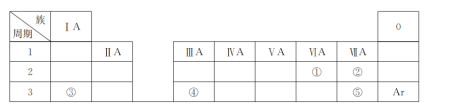
ƒøƒ⁄»ð
°æƒø°ø◊Ë»ºº¡”÷≥∆∑¿ªº¡£¨÷˜“™”√”⁄—”≥ŸªÚ∑¿÷πø…»ºŒÔµƒ»º…’°£∏˘æð◊È≥…£¨◊Ë»ºº¡ø…∑÷Œ™¬±œµ◊Ë»ºº¡°¢ŒÞª˙◊Ë»ºº¡µ»°£
£®1£©¬±œµ◊Ë»ºº¡∂ýŒ™”–ª˙¬»ªØŒÔ∫Õ”–ª˙‰ÂªØŒÔ£¨ л»ª·∑÷Ω‚≤˙…˙¬±ªØ«‚£®HX£©£¨∆µΩ◊Ë»º◊˜”√°£¬±ªØ«‚µƒµÁ◊” ΩŒ™____£ªHF°¢HCl°¢HBr°¢HIÀƒ÷÷¬»ªØ«‚µƒ∑–µ„”…∏þµΩµÕµƒÀ≥–Ú «___°£
£®2£©‰Â¿Î◊”µƒ◊ÓÕ‚≤„µÁ◊”≈≈≤º Ω «___£ª¬»‘≠◊”µƒ∫ÀÕ‚µÁ◊”‘∆”–___÷÷…Ï’π∑ΩœÚ°£
£®3£©œ¬¡–ƒÐÀµ√˜¬»µƒ∑«Ω Ù–‘«ø”⁄‰Âµƒ ¬ µ «___£®—°ÃÓ±ý∫≈£©°£
a£ÆHClOÀ·–‘«ø”⁄HBrO
b£ÆHBrµƒ∑÷Ω‚Œ¬∂»µÕ”⁄HCl
c£ÆœÚ‰ÂªØ—«Ã˙»Ð“∫÷–µŒ»Î…Ÿ¡ø¬»ÀÆ£¨»Ð“∫—’…´±‰ª∆
d£ÆBrCl+H2O °˙HBrO+HCl «∑«—ıªØªπ‘≠∑¥”¶
ŒÞª˙◊Ë»ºº¡÷–£¨«‚—ıªØ¬¡∫Õ«‚—ıªØ√æ¡Ω÷÷◊Ë»ºº¡’ºæð◊≈÷ÿ“™Œª÷√°£¡Ω’þµƒ◊Ë»ºª˙¿Ì∂º «‘⁄¥ÔµΩ»»∑÷Ω‚Œ¬∂» ±—∏ÀŸ∑÷Ω‚Œ™—ıªØŒÔ”ÎÀÆ£¨∆µΩŒ¸»»ΩµŒ¬µƒ◊˜”√°£
£®4£©–¥≥ˆ«‚—ıªØ¬¡‘⁄À·–‘»Ð“∫÷–µƒµÁ¿Î∑Ω≥à Ω___°£
£®5£©¡Ω÷÷◊Ë»ºº¡µƒ∑÷Ω‚≤˙ŒÔ‘⁄◊‘»ªΩÁ÷–◊Ó”–ø…ƒÐ≥…Œ™‘≠◊”æßõƒ «___°££®ÃÓªØ—ß Ω£©
£®6£©ŒÞÀÆúÀ·√æ“≤ «“ª÷÷–¬–Ռު˙◊Ë»ºº¡£¨≥˝¡Àæþ”–µ•Œª÷ ¡øŒ¸»»¡ø∏¸¥ÛµƒÃÿµ„Õ‚£¨ªπƒÐ Õ∑≈æþ”–√ª◊˜”√µƒ∆¯Ã°£–¥≥ˆ∏√∆¯ÃµƒΩ·ππ Ω___°£
£®7£©”Î√æ¿Î◊”∫ÀÕ‚µÁ◊”≈≈≤ºœýÕ¨µƒ¡ÌÕ‚¡Ω∏ˆ—Ù¿Î◊”µƒ∞Îæ∂¥Û–°πÿœµŒ™___£®ÃÓŒ¢¡£∑˚∫≈£©°£
°æ¥∞∏°ø![]() HF£æHI£æHBr£æHCl 4s24p6 4 bd Al(OH)3
HF£æHI£æHBr£æHCl 4s24p6 4 bd Al(OH)3![]() Al3++3OH- Al2O3 O=C=O Na+>Al3+
Al3++3OH- Al2O3 O=C=O Na+>Al3+
°æΩ‚Œˆ°ø
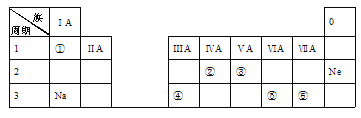
(1)¬±Àÿ‘≠◊”µƒ◊ÓÕ‚≤„µÁ◊” ˝æ˘Œ™7∏ˆ£¨¬±ªØ«‚æ˘Œ™π≤º€–Õ∑÷◊”£¨«“HF∑÷◊”º‰¥Ê‘⁄«‚º¸£ª
(2)‰Â‘≠◊”∫ÀµÁ∫… ˝Œ™35£ª¬»‘≠◊”µƒ∫ÀÕ‚µÁ◊”≈≈≤º ΩŒ™1s22s22p63s23p5£ª
(3)‘™Àÿµƒ∑«Ω Ù–‘‘Ω«ø£¨∆‰µ•÷ µƒ—ıªØ–‘‘Ω«ø°¢∆‰◊Ó∏þº€—ıªØŒÔµƒÀÆ∫œŒÔÀ·–‘‘Ω«ø°¢∆‰«‚ªØŒÔµƒŒ»∂®–‘‘Ω«ø°¢∆‰µ•÷ ”Ϋ‚∆¯ªØ∫œ‘Ω»ð“◊°¢∆‰∂‘º¸∫œµ•÷ µƒŒ¸“˝¡¶‘Ω¥Û£ª
(4)«‚—ıªØ¬¡ «¡Ω–‘«‚—ıªØŒÔ£¨ƒÐ”ÎÀ·∑¥”¶…˙≥…—Œ∫ÕÀÆ£ª
(5)«‚—ıªØ¬¡∫Õ«‚—ıªØ√浃∑÷Ω‚≤˙ŒÔ≥˝ÀÆÕ‚£¨ªπ”–Al2O3∫ÕMgO£¨∆‰÷–MgµƒΩ Ù–‘±»AlµƒΩ Ù–‘ªÓ∆√£ª
(6)úÀ·√æ∏þŒ¬∑÷Ω‚…˙≥…MgO∫ÕCO2£¨∆‰÷–CO2 «÷±œþ–Õ∑«º´–‘∑÷◊”£ª
(7)”Î√æ¿Î◊”∫ÀÕ‚µÁ◊”≈≈≤ºœýÕ¨µƒ¡ÌÕ‚¡Ω∏ˆ—Ù¿Î◊”Œ™Na+∫ÕAl3+£¨∫ÀµÁ∫… ˝¥Û£¨¿Î◊”∞Îæ∂–°°£
(1)¬±Àÿ‘≠◊”µƒ◊ÓÕ‚≤„µÁ◊” ˝æ˘Œ™7∏ˆ£¨¬±ªØ«‚÷–H∫ÕX÷ƺ‰¥Ê‘⁄“ª∏ˆπ≤”√µÁ◊”∂‘£¨‘ÚHXµƒµÁ◊” ΩŒ™![]() £¨HXæ˘Œ™π≤º€–Õ∑÷◊”£¨œý∂‘∑÷◊”÷ ¡ø‘Ω¥Û£¨∑÷◊”º‰◊˜”√¡¶‘Ω¥Û£¨∑–µ„‘Ω∏þ£¨µ´HF∑÷◊”º‰¥Ê‘⁄«‚º¸£¨∆‰∑–µ„±»∆‰À¸HX∏þ£¨‘ÚHF°¢HCl°¢HBr°¢HIÀƒ÷÷¬»ªØ«‚µƒ∑–µ„”…∏þµΩµÕµƒÀ≥–Ú «HF£æHI£æHBr£æHCl£ª
£¨HXæ˘Œ™π≤º€–Õ∑÷◊”£¨œý∂‘∑÷◊”÷ ¡ø‘Ω¥Û£¨∑÷◊”º‰◊˜”√¡¶‘Ω¥Û£¨∑–µ„‘Ω∏þ£¨µ´HF∑÷◊”º‰¥Ê‘⁄«‚º¸£¨∆‰∑–µ„±»∆‰À¸HX∏þ£¨‘ÚHF°¢HCl°¢HBr°¢HIÀƒ÷÷¬»ªØ«‚µƒ∑–µ„”…∏þµΩµÕµƒÀ≥–Ú «HF£æHI£æHBr£æHCl£ª
(2)‰Â‘≠◊”∫ÀµÁ∫… ˝Œ™35£¨‘ډ¿Î◊”µƒ◊ÓÕ‚≤„µÁ◊”≈≈≤º ΩŒ™4s24p6£ª¬»‘≠◊”µƒ∫ÀÕ‚µÁ◊”≈≈≤º ΩŒ™1s22s22p63s23p5£¨π≤”–1s°¢2s°¢2p°¢3s°¢3p4∏ˆƒÐº∂£¨”÷sπϵ¿”–1÷÷≤ªÕ¨µƒ…Ï’π∑ΩœÚ£¨pπϵ¿”–3÷÷≤ªÕ¨µƒ…Ï’π∑ΩœÚ£¨À˘“‘¬»‘≠◊”π≤”–4÷÷≤ªÕ¨µƒ…Ï’π∑ΩœÚ£ª
(3)a£Æ‘™Àÿµƒ∑«Ω Ù–‘‘Ω«ø£¨∆‰◊Ó∏þº€—ıªØŒÔµƒÀÆ∫œŒÔÀ·–‘‘Ω«ø£¨µ´HClO∫ÕHBrOæ˘≤ª «◊Ó∏þº€—ıªØŒÔµƒÀÆ∫œŒÔ£¨‘ÚŒÞ∑®∏˘æðHClOÀ·–‘«ø”⁄HBrO≈–∂œ∑«Ω Ù–‘Cl£æBr£¨π a¥ÌŒÛ£ª
b£ÆHBrµƒ∑÷Ω‚Œ¬∂»µÕ”⁄HCl£¨Àµ√˜HBrΩœ≤ªŒ»∂®£¨‘Úø…Àµ√˜¬»µƒ∑«Ω Ù–‘«ø”⁄‰Â£¨π b’˝»∑£ª
c£ÆœÚFeBr2»Ð“∫÷–µŒº”…Ÿ¡ø¬»ÀÆ£¨ªπ‘≠–‘£∫Fe2+£æBr-£¨…Ÿ¡ø¬»∆¯œ»—ıªØFe2+…˙≥…Fe3+£¨Fe3+‘⁄»Ð“∫÷–≥ œ÷«≥ª∆…´£¨≤ªƒÐ÷§√˜¬»µƒ∑«Ω Ù–‘«ø”⁄‰Â£¨π c¥ÌŒÛ£ª
d£ÆBrCl+H2O °˙HBrO+HCl «∑«—ıªØªπ‘≠∑¥”¶Àµ√˜≤ª¥Ê‘⁄‘™ÀÿªØ∫œº€µƒ±‰ªØ£¨‘ÚBrCl÷–¬»‘™ÀÿŒ™-1º€£¨ø…÷™¬»‘≠◊”Œ¸“˝µÁ◊”ƒÐ¡¶«ø£¨º¥¬»‘™Àÿµƒ∑«Ω Ù–‘«ø”⁄‰Â£¨π d’˝»∑£ª
π ¥∞∏Œ™bd£ª
(4)«‚—ıªØ¬¡ «¡Ω–‘«‚—ıªØŒÔ£¨ƒÐ”ÎÀ·∑¥”¶…˙≥…—Œ∫ÕÀÆ£¨œ‘ºÓ–‘£¨‘Ú«‚—ıªØ¬¡‘⁄À·–‘»Ð“∫÷–µƒµÁ¿Î∑Ω≥Ã ΩŒ™Al(OH)3![]() Al3++3OH-£ª
Al3++3OH-£ª
(5)«‚—ıªØ¬¡∫Õ«‚—ıªØ√浃∑÷Ω‚≤˙ŒÔ≥˝ÀÆÕ‚£¨ªπ”–Al2O3∫ÕMgO£¨“ÚMgµƒΩ Ù–‘±»AlµƒΩ Ù–‘«ø£¨‘Ú‘⁄◊‘»ªΩÁ÷–◊Ó”–ø…ƒÐ≥…Œ™‘≠◊”æßõƒ «Al2O3£ª
(6)úÀ·√æ∏þŒ¬∑÷Ω‚…˙≥…MgO∫ÕCO2£¨∆‰÷–CO2 «÷±œþ–Õ∑«º´–‘∑÷◊”£¨∆‰Ω·ππ ΩŒ™O=C=O£ª
(7)”Î√æ¿Î◊”∫ÀÕ‚µÁ◊”≈≈≤ºœýÕ¨µƒ¡ÌÕ‚¡Ω∏ˆ—Ù¿Î◊”Œ™Na+∫ÕAl3+£¨∫ÀµÁ∫… ˝¥Û£¨¿Î◊”∞Îæ∂–°£¨‘Ú¡Ω—Ù¿Î◊”µƒ∞Îæ∂¥Û–°πÿœµŒ™Na+>Al3+°£

 Ω‘ø≥◊ ‘æÌœµ¡–¥∞∏
Ω‘ø≥◊ ‘æÌœµ¡–¥∞∏