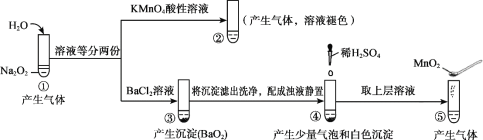
题目内容
【题目】某学习小组为了探究碳与浓H2SO4反应的产物,将浓H2SO4和木炭反应产生的气体进行以下实验:
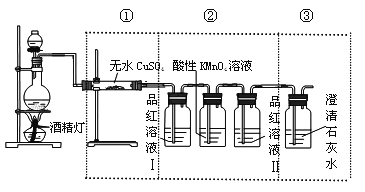
(1)气体通过无水硫酸铜,固体变蓝。说明气体中含有__________;
(2)气体通入品红溶液,溶液褪色;微热,溶液恢复红色。说明气体中含有__________(填“SO2”或“CO2”);
(3)气体通入足量的澄清石灰水,产生白色沉淀。该小组认为气体中含有CO2,你认为该结论:__________(填“正确”或“不正确)。
【答案】H2O (或水) SO2 正确
【解析】
依据常见气体的检验方法结合实验装置图回答。
(1)能使无水硫酸铜固体变蓝的气体为水蒸气,则说明气体中含有H2O (或水),
故答案为:H2O (或水);
(2)二氧化硫能是品红溶液褪色且加热又会恢复原来的红色,则气体通入品红溶液,溶液褪色;微热,溶液恢复红色,说明气体中含有SO2,
故答案为:SO2;
(3)根据实验装置图可看出,气体先通入品红溶液I检验二氧化硫的存在,再继续通入酸性高锰酸钾后,二氧化硫被氧化除尽后通过品红溶液II检验二氧化硫是否除尽,气体中已经排除二氧化硫的干扰,则该气体再通入足量的澄清石灰水,产生白色沉淀,能说明含有CO2,
故答案为:正确;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量[(g·(100 mL)-1]。
(Ⅰ)实验步骤
(1)用___(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂。
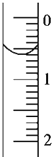
(3)读取盛装0.1000mol·L-1NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为___mL。
(4)滴定。当___时,停止滴定,并记录 NaOH溶液的终读数。重复滴定3次。
(Ⅱ)实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品)(mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗)(mL) | 15.95 | 15.00 | 15.05 | 14.95 |
(Ⅲ)数据处理与讨论
(1)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=![]() mL=15.24mL,乙指出其计算不合理。按正确数据处理,可得市售白醋总酸量=____g·(100mL)-1;
mL=15.24mL,乙指出其计算不合理。按正确数据处理,可得市售白醋总酸量=____g·(100mL)-1;
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)。
a.碱式滴定管在滴定时用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出