题目内容
8.为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.(1)若有1mol CH4生成,则有6molσ键和2molπ键断裂.
(2)CH4失去H-(氢负离子)形成CH+3(甲基正离子).已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为sp2.
分析 (1)首先判断CO2和H2分子中含有多少δ键和π键,根据化学方程式计算;
(2)根据CH3+离子的价层电子对数判断杂化轨道类型.
解答 解:(1)1个CO2和4个H2分子中共含有6个δ键和2π键,若有1molCH4生成,则有6molδ键和molπ键断裂,
故答案为:6;2;
(2)CH3+离子的价层电子对数=3+$\frac{4-1-1×3}{2}$=3,应为sp2杂化,
故答案为:sp2.
点评 本题考查了共价键的类型和杂化类型的判断,题目难度不大,注意把握共价键的类型、杂化类型的判断方法,注意解答问题的方法的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)?2SO3(g)+196.6kJ,下列说法正确的是( )
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
13.氯化亚砜(SOCl2,结构式如图:(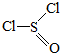 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:
SO3+SCl2═SOCl2+SO2,下列有关说法正确的是( )
 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2═SOCl2+SO2,下列有关说法正确的是( )
| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
8.在下列晶体中,一定存在共价键的是( )
| A. | 离子晶体 | B. | 分子晶体 | C. | 原子晶体 | D. | 金属晶体 |

 已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.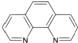 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.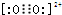 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.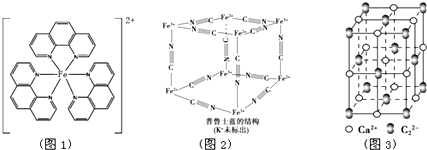
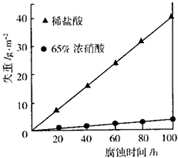 按要求回答下列问题:
按要求回答下列问题: