题目内容
9.将一定量的Fe、FeO和Fe2O3混合物投入到150 mL 2 mol•L-1的HNO3溶液中,恰好使混合物完全溶解,并生成1.12L NO气体(标准状况),在所得溶液中加入KSCN溶液,无血红色出现.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )| A. | 7 g | B. | 14 g | C. | 28 g | D. | 无法计算 |
分析 反应中硝酸体现两种性质,一是酸性,以NO3-离子存在溶液中,另一种是氧化性,被还原为NO;由于硝酸恰好反应,且在所得溶液中加入KSCN溶液,无血红色出现,则反应后生成了硝酸亚铁,根据N原子守恒计算出硝酸亚铁的物质的量,再根据铁元素守恒计算出用CO还原可得铁的物质的量及质量.
解答 解:标况下1.12LNO的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,
150 mL 2 mol•L-1的HNO3溶液中含有硝酸的物质的量为:2mol/L×0.15L=0.3mol,
由于硝酸恰好反应,且在所得溶液中加入KSCN溶液,无血红色出现,则反应后生成了硝酸亚铁,
根据N原子守恒,生成硝酸亚铁的物质的量为:$\frac{1}{2}$(0.3mol-0.05mol)=0.125mol,
即:原混合物中含有0.125mol铁元素,
若用足量的CO在高温下还原相同质量的此混合物,根据质量守恒可知,能得到铁的物质的量为0.125mol,质量为:56g/mol×0.125mol=7g,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| B. | 为了提高酒精的杀菌消毒效果,医院常用体积分数为100%的酒精 | |
| C. | 用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 石墨烯是一种从石墨材料中用“撕裂”方法“剥离”出的单层碳原子面材料,石墨烯和乙烯都属于烯烃 |
17.下列叙述中,不正确的是( )
| A. | 纤维素、淀粉均属于高分子化合物 | |
| B. | 浓硝酸沾到皮肤上能使皮肤变黄,这是由于浓硝酸和蛋白质发生了颜色反应 | |
| C. | 糖类、油脂、蛋白质都只由C、H、O三种元素组成的 | |
| D. | 利用油脂在碱性条件下的水解,可以制得肥皂和甘油 |
4.可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | H2、I2、HI的浓度相等 | B. | H2、I2、HI的浓度之比为1:1:2 | ||
| C. | 混合气体的平均相对分子质量不变 | D. | 混合气体的颜色不再改变 |
1.在醋酸溶液中加入少量下列物质,不能使醋酸的电离平衡发生移动的是( )
| A. | NaOH | B. | CH3COOH | C. | Na2CO3 | D. | NaCl |
19.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)?2SO3(g)+196.6kJ,下列说法正确的是( )
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
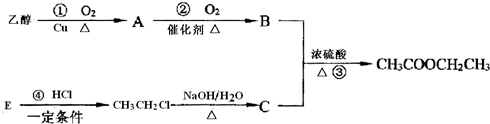
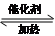 CH3COOCH2CH3+H2O;④CH2=CH2+HCl
CH3COOCH2CH3+H2O;④CH2=CH2+HCl CH3CH2Cl.
CH3CH2Cl.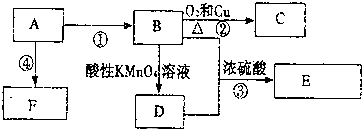
 ,F的结构简式
,F的结构简式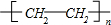 .
.