题目内容
4.已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)( )| A. | c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-) | B. | c(H+)+c(H2RO3)=c(RO32-)+c(OH-) | ||
| C. | c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-) | D. | c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+) |
分析 NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体,说明NaHSO3溶液呈酸性,则溶液中HSO3-电离程度大于水解程度,且亚硫酸氢根离子的酸性大于碳酸,
两溶液中发生的过程相似,①溶质电离:NaHRO3=Na++HRO3-,②HRO3-电离:HRO3-?H++RO32-,
③HRO3-水解:HRO3-+H2O?H2RO3+OH-,④水电离:H2O?H++OH-.
由溶液呈电中性有电荷守恒关系(a):c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-);
据化学式NaHRO3得物料守恒关系(b):c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3);
(a)-(b)得质子守恒关系(c):c(H+)+c(H2RO3)=c(RO32-)+c(OH-);
对NaHSO3溶液,过程②的程度大于③,有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
对NaHCO3溶液,过程③的程度大于②,有c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),
据此对各选项进行判断.
解答 解:NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体,说明NaHSO3溶液呈酸性,则溶液中HSO3-电离程度大于水解程度,
A.由溶液呈电中性有电荷守恒关系:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故A正确;
B.混合液中满足质子守恒:c(H+)+c(H2RO3)=c(RO32-)+c(OH-),故B正确;
C.对NaHSO3溶液,亚硫酸氢根离子的电离程度大于水解程度,则离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);对NaHCO3溶液,碳酸氢根离子的水解程度大于电离程度,则离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故C错误;
D.亚硫酸氢钠溶液呈酸性,则c(OH-)<c(H+)、c(H2RO3)<c(RO32-),碳酸氢钠溶液呈碱性,则c(OH-)>c(H+)、c(H2RO3)>c(RO32-),故D错误;
故选AB.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒质子守恒及盐的水解原理的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 石油分馏:航空煤油 | B. | 重油裂化:导电塑料 | ||
| C. | 煤的干馏:炼铁焦炭 | D. | 乙烯水化:有机溶剂 |
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
| A. | Zn 具有导电性,用作锌锰干电池的负极材料 | |
| B. | 锌的金属活泼性比铁的强,可在海轮外壳上装若干锌板以减缓其腐蚀 | |
| C. | NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨忪剂 | |
| D. | 常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸 |
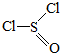 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2═SOCl2+SO2,下列有关说法正确的是( )
| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
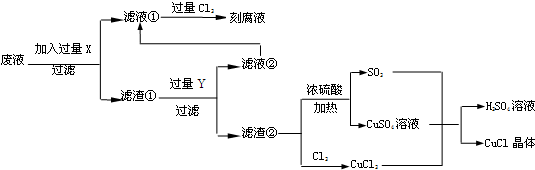
(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
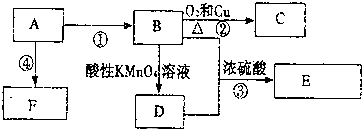
 ,F的结构简式
,F的结构简式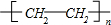 .
.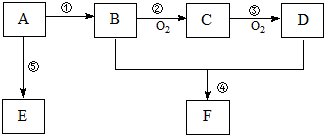
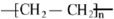 ,B中官能团的名称为羟基.
,B中官能团的名称为羟基. .
.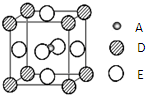 已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.