题目内容
9.向10mL 1mol•L-1 AlCl3溶液中加入1mol•L-1 NaOH溶液,得到沉淀0.26g,则刚加入的NaOH溶液的体积可能为( )| A. | 10mL 20mL | B. | 20mL 30mL | C. | 10mL 36.7mL | D. | 20mL 36.7mL |
分析 10mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.01L×1mol/L=0.01mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.01mol×78g/mol=0.78g>0.26g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:10mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.01L×1mol/L=0.01mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.01mol×78g/mol=0.78g>0.26g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{0.26g}{78g/mol}$=0.0033mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.0033mol×3=0.01mol,
加入NaOH溶液的体积为$\frac{0.01mol}{1mol/L}$=0.01L=10mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.01mol 0.03mol 0.01mol
Al(OH)3 +OH-═AlO2-+2H2O
(0.01-0.0.0033)mol (0.01-0.0.0033)mol
则消耗的碱的物质的量为0.03mol+(0.01-0.0.0033)mol=0.0367mol,
加入NaOH溶液的体积为$\frac{0.0367mol}{1mol/L}$=36.7mL;
故选C.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
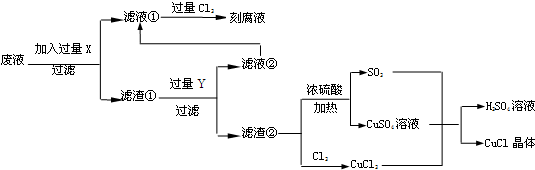
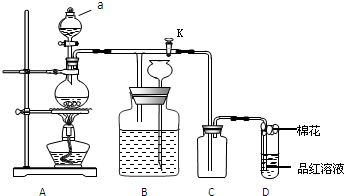
(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
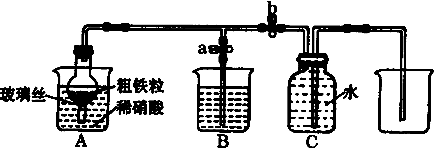
(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
| A. | 离子晶体 | B. | 分子晶体 | C. | 原子晶体 | D. | 金属晶体 |
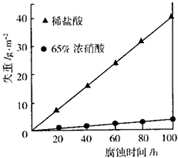 按要求回答下列问题:
按要求回答下列问题: