题目内容
10.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子的价电子排布式为3d104s1,C、N、O三种元素的第一电离能由大到小N>O>C.
(2)配离子[Cu(En)2]2+含有的微粒间的作用力类型有ABD(填选项字母);
A.配位键 B.极性键 C.离子键
D.非极性键 E.氢键 F.金属键.
分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子电子排布式,
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(2)配离子[Cu(En)2]2+中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型.
解答 解:(1)Cu是29号元素,原子核外电子数为29,Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故铜的基态原子价电子电子排布式3d104s1,
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C,
故答案为:3d104s1;N>O>C;
(2)配离子[Cu(En)2]2+中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD.
故答案为:ABD.
点评 本题考查元素价电子电子排布式、电离能大小比较、配离子化学键类型,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力,注意同一周期元素电离能变化规律,注意规律中的反常现象及其原因,为高考高频点,题目难度中等.

练习册系列答案
相关题目
1.在醋酸溶液中加入少量下列物质,不能使醋酸的电离平衡发生移动的是( )
| A. | NaOH | B. | CH3COOH | C. | Na2CO3 | D. | NaCl |
5.已知Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI).在某溶液中含有等物质的量浓度的Cl-、Br-、I-,当逐滴加入AgNO3溶液,沉淀先后出现的顺序是( )
| A. | AgI,AgBr,AgCl | B. | AgCl,AgI,AgBr | C. | AgBr,AgI,AgCl | D. | AgCl,AgBr,AgI |
2.下列解释事实的方程式不正确的是( )
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
19.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)?2SO3(g)+196.6kJ,下列说法正确的是( )
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |

 CH3COOCH2CH3+H2O;④CH2=CH2+HCl
CH3COOCH2CH3+H2O;④CH2=CH2+HCl CH3CH2Cl.
CH3CH2Cl.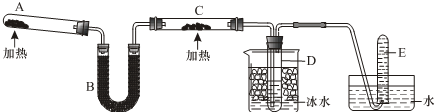
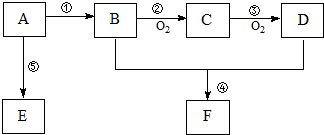
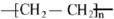 ,B中官能团的名称为羟基.
,B中官能团的名称为羟基.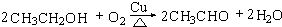 .
. 按要求回答下列问题:
按要求回答下列问题: