题目内容
11.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 常温下,10L pH=1的硫酸溶液中含有的H+数为NA | |
| B. | 将58.5g NaCl溶于1.00L水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| D. | 1molAl3+含有的核外电子数为3NA |
分析 A.根据溶液体积及氢离子浓度计算出溶液中含有的氢离子数目;
B.氯化钠溶于1L水中,所得溶液的体积不是1L;
C.1mol氯气与铁反应最多得到2mol电子;
D.铝离子核外电子数为10,1mol铝离子核外电子为10mol.
解答 解:A.pH=1的硫酸溶液中氢离子浓度为0.1mol/L,10L该硫酸溶液中氢离子物质的量为1mol,含有的H+离子数为NA,故A正确;
B.将58.5g NaCl溶于1.00L水中,所得NaCl溶液的体积不是1L,无法计算溶液的物质的量浓度,故B错误;
C.1mol Cl2与足量的铁反应,得到了2mol电子,根据电子守恒,转移的电子数为2NA,故C错误;
D.1mol铝离子含有10mol核外电子,1mol Al3+含有的核外电子数为10NA,故D错误.
故选A.
点评 本题考查阿伏伽德罗常数的有关计算和判断,题目难度中等,阿伏伽德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏伽德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏伽德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
1.在醋酸溶液中加入少量下列物质,不能使醋酸的电离平衡发生移动的是( )
| A. | NaOH | B. | CH3COOH | C. | Na2CO3 | D. | NaCl |
2.下列解释事实的方程式不正确的是( )
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
19.已知:S(s)+O2(g)→SO2(g)+297.16kJ,2SO2(g)+O2(g)?2SO3(g)+196.6kJ,下列说法正确的是( )
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
6.为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g.若硝酸的还原产物只有NO,下列说法正确的是( )
| A. | 上述测定不能达到实验目的 | B. | 剩余的7.48g金属为铜 | ||
| C. | 共生成NO气体 0.04mol | D. | 该合金中铜的质量分数为69.2% |
11.课外兴趣小组设计如图所示装置,用粗铁粒与1890g•L-1(质量分数为5%)的硝酸反应制取NO气体.请回答有关问题.
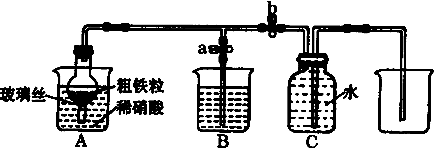
(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:

(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
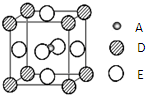 已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.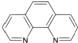 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.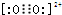 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.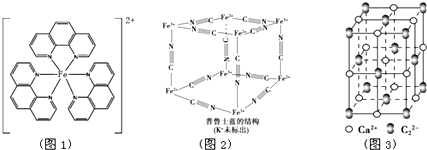
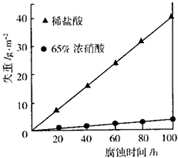 按要求回答下列问题:
按要求回答下列问题: