题目内容
7.从海水中可以获得淡水、食盐并可提取镁和溴等物质.(1)海水淡化的方法主要有海水冻结法、电渗析法、蒸馏法、离子交换法(选填其中一个);(填一种).
(2)经过化学变化才能从海水中获得的物质是ABC(填序号)
A 氯、溴、碘 B 钠、镁、铝 C 烧碱、氢气 D 食盐、淡水
(3)从海水中提取镁的流程如图所示:
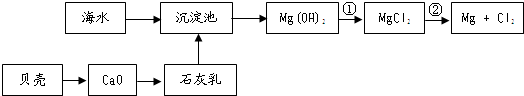
反应①的离子方程式为Mg(OH)2+2H+═Mg2++2H2O.反应②的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为2Br-+Cl2═Br2+2Cl-.
分析 (1)根据海水淡化的常用方法:海水冻结法、电渗析法、蒸馏法、离子交换法;
(2)从海水提物质的原理去分析;
(3)根据对应步骤写出对应的化学方程式或离子方程式;
(4)根据氯气能氧化溴离子得到氯离子和单质溴写出反应的离子方程式.
解答 解:(1)海水淡化的常用方法为:海水冻结法、电渗析法、蒸馏法、离子交换法,
故答案为:海水冻结法、电渗析法、蒸馏法、离子交换法(选填其中一个);
(2)A.通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子和碘离子氧化为溴单质和碘单质,是化学变化,故A正确;
B.通过电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故B正确;
C.可从海水中获得氯化钠,然后电解饱和食盐水,即得烧碱、氢气和氯气,是化学变化,故C正确;
D.把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故D错误;
故答案为:ABC;
(3)因反应①是Mg(OH)2与盐酸反应:Mg(OH)2+2HCl=MgCl2+2H2O,反应的离子方程式为:Mg(OH)2+2H+═Mg2++2H2O;
反应②是电解熔融MgCl2,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:Mg(OH)2+2H+═Mg2++2H2O;MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(4)氯气能氧化溴离子得到氯离子和单质溴,反应的离子方程式为:2Br-+Cl2═Br2+2Cl-,
故答案为:2Br-+Cl2═Br2+2Cl-.
点评 本题考查了海水资源的综合利用,题目难度中等,注意掌握海水提炼氯气、溴、碘、钠、镁、氢气等物质的原理,涉及的知识较多,综合性较强,充分考查学生的分析、理解能力及化学实验能力.

| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
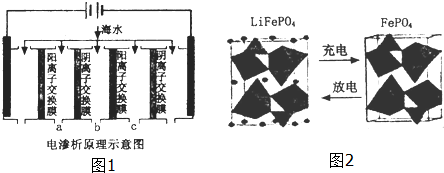
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为能传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
| A. | 28g N2、N2O、N2O4的混合气体含有氮原子数为2NA | |
| B. | 质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA | |
| C. | 0.5 mol•L-1的乙酸溶液中,乙酸分子的数目小于0.5NA | |
| D. | 78g苯分子中含有碳碳双键数为3 NA |
| A. | D氢化物的稳定性比B氢化物的稳定性强 | |
| B. | 5种元素中,E元素氧化物的水合物的酸性最强 | |
| C. | A与B、D分别可形成AB2、AD2的化合物 | |
| D. | B和C可形成离子化合物,且C离子的半径大于B离子的半径 |
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeI2 | I2 | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | O2 | Mn2+ |
| A. | 表中①组的反应中氧化产物一定是I2 | |
| B. | 氧化性强弱的比较:KClO3>Cl2>Fe3+>I2 | |
| C. | 表中②组每生成1molCl2,转移1mol电子 | |
| D. | 表中③组其他反应物可以为浓盐酸 |
| A. | 若生成物C和D分别为盐和水,则该反应一定是中和反应 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D不可能是两种沉淀 | |
| D. | 若A是可溶性碱,B是可溶性盐,则C和D一定是另一种碱和另一种盐 |

 .
.