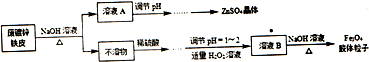
题目内容
6.某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.(1)产生的气体是CO2(填分子式).
【查阅资料】:FeCO3为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3.
(2)关于白色沉淀的成分,小组同学提出如下假设,请补充完成假设3:
假设l:白色沉淀是Fe(OH)2;
假设2:白色沉淀是FeCO3;
假设3:白色沉淀是Fe(OH)2和FeCO3;
(3)若假设1成立,写出生成Fe(OH)2的化学方程式:FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑,
经煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液的目的是除去水中溶解的氧气,防止生成的氢氧化亚铁被迅速氧化.某同学认为白色沉淀不可能为Fe(OH)2,你是否同意其观点?不同意(填“同意”或“不同意”),理由是反应体系进行了无氧处理,并且碳酸氢钠水解提供了碱性环境
(4)请设计一个实验方案验证假设2,写出实验步骤、预期现象和结论,实验所需仪器和药品自选.

分析 (1)亚铁离子和碳酸氢根离子发生双水解反应生成CO2;
(2)结合假设1、2可知白色固体可能是Fe(OH)2和FeCO3的混合物;
(3)FeSO4和NaHCO3反应生成Fe(OH)2沉淀、二氧化碳和硫酸钠;二价铁不稳定,易被氧气氧化而干扰实验;碱性条件下,亚铁离子生成Fe(OH)2沉淀;
(4)如果白色沉淀是Fe(OH)2,Fe(OH)2不稳定,极易被氧化生成Fe(OH)3;FeCO3在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3,通入空气后根据白色固体变色时间长短判断白色沉淀成分.
解答 解:(1)亚铁离子和碳酸氢根离子发生双水解反应生成CO2,所以生成的气体是CO2,故答案为:CO2;
(2)白色固体也可能是Fe(OH)2和FeCO3的混合物,所以假设3为:白色固体是Fe(OH)2和FeCO3,故答案为:Fe(OH)2和FeCO3;
(3)FeSO4和NaHCO3反应生成Fe(OH)2沉淀、二氧化碳,根据元素守恒知还生成硫酸钠,反应方程式为FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;
二价铁不稳定,易被氧气氧化而干扰实验,所以经煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液的目的是除去水中溶解的氧气,防止生成的氢氧化亚铁被迅速氧化;
反应体系进行了无氧处理并且碳酸氢钠水解提供了碱性环境,所以白色沉淀中一定含有氢氧化亚铁,
故答案为:FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;除去水中溶解的氧气,防止生成的氢氧化亚铁被迅速氧化;不同意;反应体系进行了无氧处理,并且碳酸氢钠水解提供了碱性环境;
(4)如果白色沉淀是Fe(OH)2,Fe(OH)2不稳定,极易被氧化生成Fe(OH)3;FeCO3在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3,通入空气后根据白色固体变色时间长短判断白色沉淀成分,所以其实验步骤、预期现象和结论为:向生成的白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则假设2不成立;若白色沉淀短时间内不变色,则假设2成立,
故答案为:向生成的白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则假设2不成立;若白色沉淀短时间内不变色,则假设2成立.
点评 本题考查性质实验方案设计,题目难度中等,侧重考查学生的分析、判断及实验操作能力,明确实验原理及物质性质是解本题关键,难点是(4)实验方案设计,要利用物质性质的区别设计方案.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | 上述测定不能达到实验目的 | B. | 剩余的7.48g金属为铜 | ||
| C. | 共生成NO气体 0.04mol | D. | 该合金中铜的质量分数为69.2% |
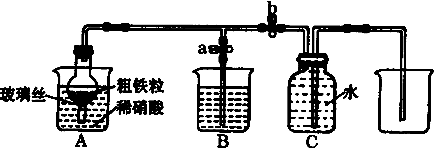
(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
| A. | 甲酸乙酯的结构简式:HCOOCH2CH3 | |
| B. | 质子数为53,中子数为75的碘原子:${\;}_{53}^{128}$I | |
| C. | 四氯化碳的电子式: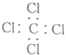 | |
| D. | 间甲基苯酚: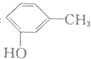 |
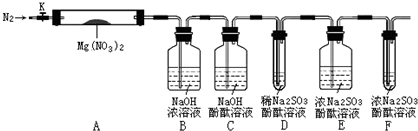
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.