题目内容
18.设NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | 28g N2、N2O、N2O4的混合气体含有氮原子数为2NA | |
| B. | 质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA | |
| C. | 0.5 mol•L-1的乙酸溶液中,乙酸分子的数目小于0.5NA | |
| D. | 78g苯分子中含有碳碳双键数为3 NA |
分析 A.N2、N2O、N2O4的含氮量不同;
B.Na2S、Na2O2摩尔质量相同,质量换算物质的量结合化学式计算阴离子数;
C.没指明溶液的体积无法计算;
D.苯分子中的碳碳键为一种介于单键和双键之间的独特键.
解答 解:A.28g N2、N2O、N2O4的混合气体含有氮原子数小于2NA,故A错误;
B.Na2S、Na2O2摩尔质量相同,质量均为7.8 g的Na2S、Na2O2的固体物质的量为0.1mol,固体中含有的阴离子数均为0.1NA,故B正确;
C.没指明溶液的体积无法计算,故C错误;
D.苯分子中的碳碳键为一种独特键,不存在碳碳双键,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意掌握阿伏伽德罗常数与物质的量、摩尔质量等物理量之间的关系,D为易错点,需要明确苯分子中的碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
8.锌粒与2mol/L的硫酸反应,用以下措施不能增大该化学反应速率的是( )
| A. | 用锌粉代替锌粒 | B. | 改用热的2 mol/L硫酸溶液 | ||
| C. | 改用3 mol/L硫酸溶液 | D. | 向该硫酸溶液中加入等体积的水 |
9.某澄清溶液中可能含有下列离子:K+、NH4+、Fe2+、Fe3+、Ba2+、SO42ˉ、HCO3ˉ、Clˉ,
为鉴别其中含有的离子,进行如下实验:
①用玻璃棒蘸取原溶液滴在pH试纸上,试纸显红色;
②另取少量原溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,生成白色沉淀.
下列关于原溶液的说法正确的是( )
为鉴别其中含有的离子,进行如下实验:
①用玻璃棒蘸取原溶液滴在pH试纸上,试纸显红色;
②另取少量原溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,生成白色沉淀.
下列关于原溶液的说法正确的是( )
| A. | 原溶液中一定不存在Ba2+和HCO3- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定存在SO42-和Cl- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
6.为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g.若硝酸的还原产物只有NO,下列说法正确的是( )
| A. | 上述测定不能达到实验目的 | B. | 剩余的7.48g金属为铜 | ||
| C. | 共生成NO气体 0.04mol | D. | 该合金中铜的质量分数为69.2% |
13.下列化学实验事实及其解释或结论都正确的是( )
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
10.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 18g D2O含有的电子数为10NA | |
| C. | 在标准状况下,22.4LSO3的物质的量为1mol | |
| D. | 同温、同压下,相同体积的氟气和氩气所含的原子数相等 |
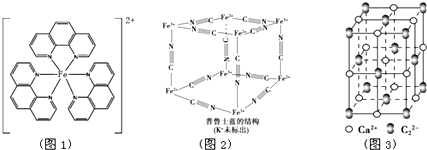
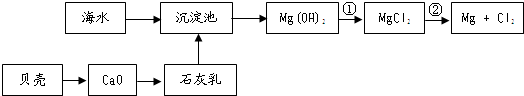
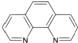 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
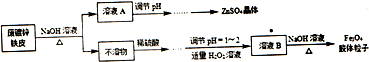
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.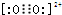 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.