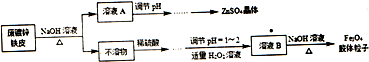
题目内容
19.对于化学反应A+B═C+D的下列说法中正确的是( )| A. | 若生成物C和D分别为盐和水,则该反应一定是中和反应 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D不可能是两种沉淀 | |
| D. | 若A是可溶性碱,B是可溶性盐,则C和D一定是另一种碱和另一种盐 |
分析 A、生成盐和水的反应不一定是中和反应,如氧化铜和硫酸反应生成硫酸铜和水;
B、单质与化合物反应生成另外的一种单质与一种化合物的反应,称为置换反应;
C、碱和盐反应可能生成两种沉淀,例如A为氢氧化钡溶液,B为硫酸铜溶液,反应生成硫酸钡沉淀和氢氧化铜沉淀;
D、碱和盐反应可能生成盐和水,例如A为氢氧化钠溶液,B为碳酸氢钠溶液,反应生成碳酸钠和水;
解答 解:A、中和反应的反应物是酸与碱,生成物是盐和水,但产物是盐和水的反应不一定是中和反应,如氧化铜和硫酸反应生成硫酸铜和水等,故A错误;
B、若A和C是单质,B和D是化合物,符合单质与化合物反应生成另外的一种单质与一种化合物,故B正确;
C、若A为碱溶液,B为盐溶液,则C、D可能是两种沉淀,例如A为氢氧化钡溶液,B为硫酸铜溶液,反应生成硫酸钡沉淀和氢氧化铜沉淀,故C错误;
D、若A是可溶性碱,B是可溶性盐,则C、D可能是盐和水,例如A为氢氧化钠溶液,B为碳酸氢钠溶液,反应生成碳酸钠和水,故D错误;
故选B.
点评 本题着重考查对中和反应及其他基本反应类型概念的准确理解,并会灵活分析进行解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某澄清溶液中可能含有下列离子:K+、NH4+、Fe2+、Fe3+、Ba2+、SO42ˉ、HCO3ˉ、Clˉ,
为鉴别其中含有的离子,进行如下实验:
①用玻璃棒蘸取原溶液滴在pH试纸上,试纸显红色;
②另取少量原溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,生成白色沉淀.
下列关于原溶液的说法正确的是( )
为鉴别其中含有的离子,进行如下实验:
①用玻璃棒蘸取原溶液滴在pH试纸上,试纸显红色;
②另取少量原溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液加入酸化的硝酸银溶液,生成白色沉淀.
下列关于原溶液的说法正确的是( )
| A. | 原溶液中一定不存在Ba2+和HCO3- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定存在SO42-和Cl- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
10.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 18g D2O含有的电子数为10NA | |
| C. | 在标准状况下,22.4LSO3的物质的量为1mol | |
| D. | 同温、同压下,相同体积的氟气和氩气所含的原子数相等 |
14.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?若a=7,则HA是强酸;若a>7,则HA是弱酸.
(2)若考虑其他组的实验结果,则c1>(填“<”、“>”或“=”)0.2mol•L-1;乙组实验中HA和NaOH溶液混合前,HA溶液中C(A-)与NaOH溶液中C(Na+)的关系是B
A.前者大 B.后者大 C.二者相等 D.无法判断.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);其中,C(A-)=0.1+1×10-9-1×10-5mol•L-1(不能做近似计算,回答准确值,结果不一定要化简).
(4)丁组实验中,HA和NaOH溶液混合前后C(HA)>(填“<”、“>”或“=”)C(NaOH);b<7(填“<”、“>”或“=”)
| 实验编号 | HA | NaOH | 混合后溶液的pH |
| 甲 | C(HA)=0.2mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=a |
| 乙 | C(HA)=c1mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=7 |
| 丙 | C(HA)=0.1mol•L-1 | C(NaOH)=0.1mol•L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?若a=7,则HA是强酸;若a>7,则HA是弱酸.
(2)若考虑其他组的实验结果,则c1>(填“<”、“>”或“=”)0.2mol•L-1;乙组实验中HA和NaOH溶液混合前,HA溶液中C(A-)与NaOH溶液中C(Na+)的关系是B
A.前者大 B.后者大 C.二者相等 D.无法判断.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);其中,C(A-)=0.1+1×10-9-1×10-5mol•L-1(不能做近似计算,回答准确值,结果不一定要化简).
(4)丁组实验中,HA和NaOH溶液混合前后C(HA)>(填“<”、“>”或“=”)C(NaOH);b<7(填“<”、“>”或“=”)
19.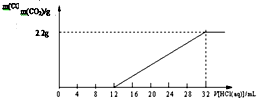 某碳酸钾和碳酸氢钾的混合样品61.4g,加水溶解后,取所得溶液的$\frac{1}{10}$,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线,下列说法不正确的是( )
某碳酸钾和碳酸氢钾的混合样品61.4g,加水溶解后,取所得溶液的$\frac{1}{10}$,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线,下列说法不正确的是( )
 某碳酸钾和碳酸氢钾的混合样品61.4g,加水溶解后,取所得溶液的$\frac{1}{10}$,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线,下列说法不正确的是( )
某碳酸钾和碳酸氢钾的混合样品61.4g,加水溶解后,取所得溶液的$\frac{1}{10}$,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线,下列说法不正确的是( )| A. | 该过程所发生反应的化学方程式:K2CO3+HCl═KCl+KHNO3,KHNO3+HCl═KCl+H2O+CO2↑ | |
| B. | 混合样品中碳元素的质量分数为8.5% | |
| C. | 混合样品中含碳酸钾41.4g | |
| D. | 将原混合液体充分加热后,再加入足量的盐酸,整个过程中产生的CO2总量不变 |

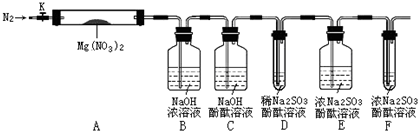
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.