题目内容
12.用30g乙酸和40g乙醇反应,如果实验产率是理论产率的85%,可以得到多少克乙酸乙酯?分析 反应的方程式为:CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,结合方程式计算.
解答 解:30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,40g乙醇的物质的量为$\frac{40}{46}$mol=0.87mol,
反应的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,由此可知乙醇过量,则
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
1mol 1mol
0.5mol×85% n
n=0.5mol×85%=0.425mol
m(CH3COOCH2CH3)=0.425mol×88g/mol=37.4g,
答:可以得到37.4g乙酸乙酯.
点评 本题考查化学方程式的计算,题目难度不大,注意反应的理论产率的运用以及反应方程式的书写.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
2.下列解释事实的方程式不正确的是( )
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
11.课外兴趣小组设计如图所示装置,用粗铁粒与1890g•L-1(质量分数为5%)的硝酸反应制取NO气体.请回答有关问题.

(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:

(1)1890g•L-1硝酸的物质的量浓度为1.5mol•L-1.
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是NO与空气中的O2反应,NO与空气密度接近.
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是金属不断溶解,有气体产生逐渐变为红棕色.B装置烧杯中液体的作用是吸收氮的氧化物.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(4)该实验中,若去掉B装置,对实验结果是否有影响?无影响.
(5)将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是$\frac{3b}{4}$mol(2amol或3amol或2amol~3amol)(用含a和b的代数式表示).
(6)完全反应后,A装置烧杯里含铁的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管.0.1mol•L-1KSCN溶液、0.1mol•L-1KI溶液、0.2mol•L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
12.当光束通过肥皂水溶液时,从侧面观察到一条明亮的“光道”,说明肥皂水溶液属于( )
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
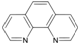 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个. .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.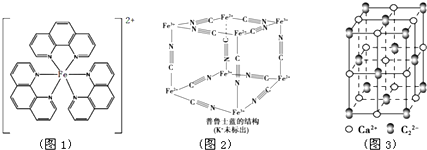
 按要求回答下列问题:
按要求回答下列问题: