题目内容
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为____________,该操作将I2还原为I-的目的是____________;
(2)操作X的名称为____________;
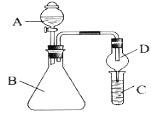
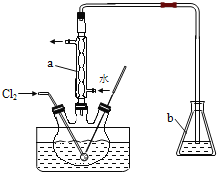
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示).实验室控制在较低温度下进行的原因是____________;仪器b中盛放的溶液为_____。
(4)已知:5SO32-+2IO3-+2H+═I2+5SO42-+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种,请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
①取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在:
②____________;
③另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝色,说明废水中含有IO3-,否则说明废水中不含IO3-。
(5)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用ClO2氧化酸性含I-废液回收碘。
①完成ClO2氧化I-的离子方程式:□ClO2+□I-+□____________=□I2+□Cl-+□____________
②若处理含I-相同量的废液回收碘,所需Cl2的物质的量是ClO2的____________倍
【答案】
(1)SO32-+I2+H2O=2I-+2H++SO42-;使四氯化碳中的碘进入水层;
(2)分液;
(3)使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液
(4)从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,若溶液变蓝色,说明废水中含有I-,否则不含I-。
(5)①2、10、8H+、5、2、4H2O;②2.5;
【解析】
试题分析:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子;故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使四氯化碳中的碘进入水层;
(2)四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;故答案为:分液;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,故答案为:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2 IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-,故答案为:从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,若溶液变蓝色,说明废水中含有I-,否则不含I-。
(5)①用ClO2氧化酸性含I-废液回收碘,是二氧化氯在酸溶液中氧化碘离子生成碘单质,二氧化氯被还原为氯离子,ClO2~Cl-~5e-,2I-~I2~2e-,反应的离子方程式为:2ClO2+10I-+8H+=5I2+2Cl-+4H2O,故答案为:2、10、8H+、5、2、4H2O;
②依据氧化还原反应电子守恒计算,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5。

 名校课堂系列答案
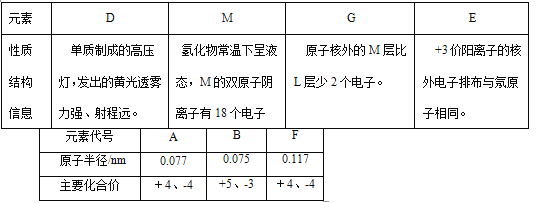
名校课堂系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。
【题目】【加试题】Ⅰ煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g)+H2O (g)H2 (g)+CO2 (g)平衡常数K随温度的变化如下表
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2 (g)2CO (g)平衡常数K1
C(s)+H2O (g)H2 (g)+CO (g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).