题目内容
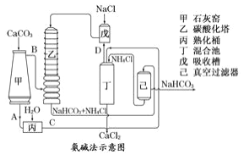
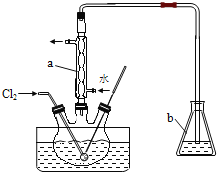
【题目】i.利用下图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为______,干燥管D的作用是______。
(2)若要证明非金属性:C1>I,则A中加浓盐酸,B中加______(填名称),C中加淀粉-碘化钾溶液,观察到C中溶液______的现象,即可证明。从环境保护的观点 ,此装置的不足之处是_________。
(3)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加_________(填试剂)即可证明。乙同学认为此方案有不足之处,应在B、D两装置间加装有_________(填试剂)的洗气瓶。
ii.金属Na、Mg、Al有广泛的应用
(4)金属Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0g金属钠和镁,分别加入到5mL水中,钠与谁反应剧烈,镁与水反应缓慢。
实验2:各取1.0g的镁条和铝条,分别加入到5mL1.0mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
实验1和实验2得出的结论是_________,用原子结构理论解释;同周期元素从左到右,_________。
(5)Na、Mg、Al都可用于制备储氢的金属氢化物。
① NaH是离子化合物,其电子式为_________。能与水发生氧化还原反应生成H2,该反应的还原剂是_________。NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学式为_________。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是_________。
【答案】(1)分液漏斗 防倒吸
(2)高锰酸钾、氯酸钾、次氯酸盐均可 变蓝 缺少尾气处理装置
(3)NaSiO3溶液 饱和NaHCO3溶液
(4)金属性Na>Mg>Al 原子半径逐渐减小,失电子能力逐渐减弱
(5)①![]() H2O 3NaH+Fe2O3=2Fe+3NaOH②NaAlH4+2H2O=NaAlO2+4H2↑
H2O 3NaH+Fe2O3=2Fe+3NaOH②NaAlH4+2H2O=NaAlO2+4H2↑
【解析】试题分析:(1)仪器A具有球形特征的漏斗且带有玻璃活塞,该仪器名称是分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,浓盐酸和酸性高锰酸钾溶液反应生成氯气,2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,所以B中加高锰酸钾,也可用氯酸钾、次氯酸盐,氯气能氧化碘离子生成碘Cl2+2I-=I2+2Cl-,碘遇淀粉变蓝,验证非金属性Cl>I,所以看到的现象是溶液变蓝色;氯气有毒,不能直接排空,能和水反应生成酸,可以用碱液NaOH处理尾气,所以此装置的不足之处是缺少尾气处理装置;
(3)在A中加盐酸,B中加CaCO3,根据较强酸制较弱酸原理,碳酸钙与盐酸反应生成二氧化碳:CaCO3+2HCl═CaCl2+CO2↑+H2O,元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,若要证明非金属性:C>Si,C中需放硅的最高价氧化物对应的酸硅酸的盐,所以C中放硅酸钠,在C中通入二氧化碳气体生成硅酸沉淀,反应的方程式为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,说明碳酸酸性比硅酸强,从而说明非金属性:C>Si,因为盐酸的挥发性导致生成的二氧化碳中含有盐酸,盐酸和硅酸钠反应干扰二氧化碳的检验,应该用饱和碳酸氢钠溶液除去盐酸;
(4)实验1:取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢,说明钠比镁活泼;实验2:取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈,说明镁比铝活泼,综上可得结论:金属的活泼性Na>Mg>Al;同周期从左到右,原子半径逐渐减小,失去电子的能力逐渐减弱;
(5)①NaH是离子化合物,电子式为![]() ;Na为+1价,H为-1价,与水发生了氧化还原反应后-1价的H变为0价,化合价升高,被氧化,自身作还原剂,水是氧化剂;NaH具有还原性,在无水条件下与Fe2O3发生反应的化学方程式为3NaH+Fe2O3=2Fe+3NaOH。
;Na为+1价,H为-1价,与水发生了氧化还原反应后-1价的H变为0价,化合价升高,被氧化,自身作还原剂,水是氧化剂;NaH具有还原性,在无水条件下与Fe2O3发生反应的化学方程式为3NaH+Fe2O3=2Fe+3NaOH。
②NaAlH4是一种良好的储氢材料,NaAlH4中Na为+1价,Al为+3价,H为-1价,发生氧化还原反应后产生H2的同时,生成NaAlO2,NaAlH4与水反应的化学方程式是为NaAlH4+2H2O=NaAlO2+4H2↑。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |

请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
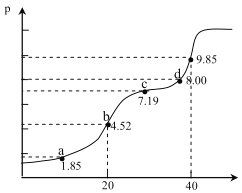
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。
(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)