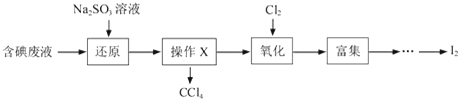
题目内容
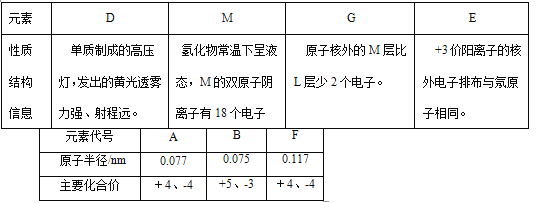
【题目】下表是部分短周期元素的信息,用化学用语回答下列问题。
(1)元素A在周期表中的位置 。B的某种核素中中子数比质子数多1,则表示该核素的原子符号为 。
(2)写出钙与M原子个数比为1:2化合物的电子式 钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键) 。
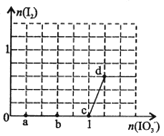
(3)M2-、D+、G2-离子半径大小顺序是 > > (用离子符号回答)。
(4)由A、B、M及氢四种原子构成的分子A2H5BM2,既可以和盐酸反应又可以和氢氧化钠溶液反应,写出A2H5BC2的名称 。
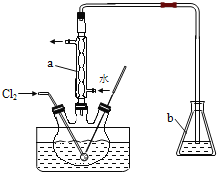
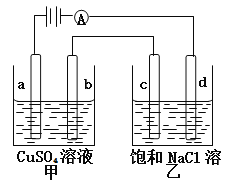
(5)某同学设计实验证明A、B、F的非金属性强弱关系。
① 溶液a和b分别为 , 。
② 溶液c中的离子方程式为 。
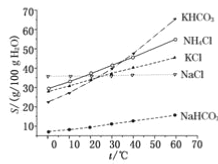
(6)将0.5 mol D2M2投入100 mL 3 mol/L ECl3溶液中,转移电子的物质的量为 。
(7)工业上冶炼E,以石墨为电极,阳极产生的混合气体的成分为 。
【答案】(1)第二周期ⅣA族715N
(2)![]() 离子键和非极性键
离子键和非极性键
(3)S2->O2->Na+
(4)甘氨酸
(5)①硝酸(HNO3)饱和NaHCO3溶液②SiO32-+CO2+H2O=H2SiO3↓+CO32-
(6)0.5mol
(7)O2CO2(或CO)
【解析】试题分析:主族元素中,元素最高化合价与其族序数相等,最低负价=族序数-8,同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,根据元素化合价知,A、F属于第IVA族,且A原子半径小于F,所以A是C元素、F是Si元素;B是第IIA族元素,B原子半径小于A,所以B是N元素;D单质制成的高压灯,发出的黄光透雾力强、射程远,D是Na元素;M氢化物常温下呈液态,M的双原子阴离子有18个电子,M是O元素;G原子核外的M层比L层少2个电子,G是S元素;E+3价阳离子的核外电子排布与氖原子相同,E是Al元素;
(1)元素C元素在周期表中的位置第二周期ⅣA族。N元素的某种核素中中子数比质子数多1,则表示该核素的原子符号为715N。
(2)写出钙与O原子个数比为1:2化合物是![]() ,电子式是
,电子式是![]() ,
,![]() 化学键类型离子键、非极性键。
化学键类型离子键、非极性键。
(3)电子层数越多半径越大、层数相同时,质子数越多半径越小,O2-、Na+、S2-离子半径大小顺序是S2->O2->Na+。
(4)由C、N、O、H四种原子构成的分子C2H5NO2,既可以和盐酸反应又可以和氢氧化钠溶液反应,说明分子具有两性,所以是氨基酸,C2H5NO2的名称甘氨酸。
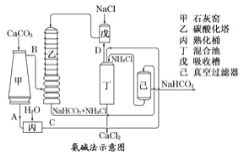
(5)某同学设计实验,利用最高价含氧酸的酸性比较C、N、Si的非金属性强弱关系。
① 溶液a和b分别为硝酸,饱和碳酸氢钠。碳酸钙和硝酸生成二氧化碳,用饱和碳酸氢钠溶液除去二氧化碳中的硝酸;
② 溶液c是硅酸钠,通入二氧化碳反应生成硅酸沉淀,离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。
(6)将0.5 mol Na2O2投入100 mL 3 mol/L AlCl3溶液中,只有过氧化钠与水反应是氧化还原,转移电子的物质的量为0.5 mol。
(7)工业上冶炼Al,以石墨为电极电解熔融氧化铝,阳极产生的混合气体的成分为O2CO2。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
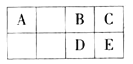
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
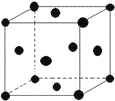
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。