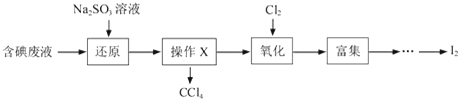
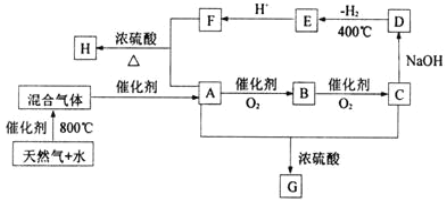
题目内容
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
【甲同学】 设计了如图1装置来一次性完成验证非金属性S>C>Si的实验研究;
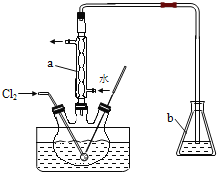
【乙同学】 设计了如图2装置来验证卤族元素性质的递变规律。
A、B两处分别是浸有NaBr溶液的棉花、湿润的淀粉KI试纸,

(1)①甲同学设计实验的依据是 。
② A溶液的名称是 。
③ 烧杯中C发生反应的离子方程式为 。
(2)乙同学的实验原理是通过观察玻璃管中的实验现象,验证卤族元素性质的递变。
① 写出A处发生反应的离子方程式 。
② B处的实验现象为 。
【答案】(1)①最高价氧化物水化物的酸性越强,对应元素的非金属性越强 ②稀硫酸
③CO2+SiO32-+H2O=H2SiO3↓+CO32-
(2)①Cl2+2Br-=Br2+2Cl-②试纸变蓝
【解析】试题分析:(1)①根据较强酸制备较弱酸可知甲同学设计实验的依据是最高价氧化物水化物的酸性越强,对应元素的非金属性越强;
②S元素的最高价含氧酸是硫酸,则A中盛放的溶液是稀硫酸;
③稀硫酸与碳酸盐反应生成二氧化碳,二氧化碳通入硅酸钠溶液中产生硅酸沉淀,则C中反应的离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-。
(2)①高锰酸钾氧化浓盐酸生成氯气,氯气具有强氧化性,能把溴离子氧化,则图2中A处反应的离子方程式为 Cl2 +2Br—=2Cl—+Br2。
②过量的氯气以及产生的溴都能把碘化钾氧化为单质碘,则B处的实验现象是试纸变蓝。

【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
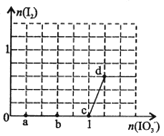
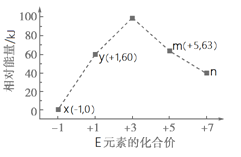
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。
(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)