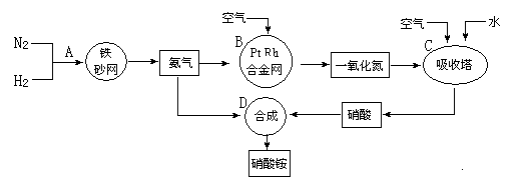
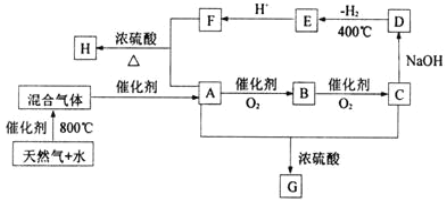
题目内容
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
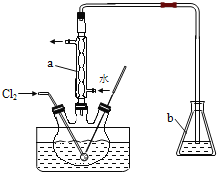
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。
【答案】(1)146C H-C≡C-H , CaC2+ H2O→Ca (OH)2+C2H2 ↑
(2)68.5g (2分)
(3)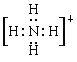 取少许于试管中,加浓的氢氧化钠溶液,若产生的气体可以使湿润的红色石蕊试纸变蓝,可证明。
取少许于试管中,加浓的氢氧化钠溶液,若产生的气体可以使湿润的红色石蕊试纸变蓝,可证明。
(4)三周期 VⅠA S2-+Cl2=S+2Cl- 34 H2SeO4
S2-+Cl2=S+2Cl- 34 H2SeO4
(5)Cl2+2NaOH=NaCl+ NaClO+H2O![]()
【解析】试题分析:X原子最外层电子数是次外层电子数的2倍,则X是碳元素;常温下Y单质为双原子分子,其氢化物水溶液呈碱性,所以Y是N;T原子最外层电子数是电子层数的3倍,因此T是S;Z元素最高正价是+7价,则Z为Cl;
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物是乙炔,结构式为H-C≡C-H,实验室制取该气体的化学方程式是CaC2+ H2O→Ca (OH)2+C2H2 ↑。
(2)将9g单质X在足量氧气中燃烧,所得气体是二氧化碳,物质的量是9g÷12g/mol=0.75mol,通入1L 1mol·L-1NaOH溶液中,氢氧化钠是1mol,设碳酸钠是xmol、碳酸氢钠是ymol,则x+y=0.75、2x+y=1,解得x=0.25,y=0.5,因此完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为0.25mol×106g/mol+84g/mol×0.5mol=68.5g。
(3)元素Y与氢元素形成一种离子YH,即为铵根,该微粒的电子式为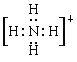 。铵根能与碱反应产生氨气,则实验室检验铵根的方法是取少许于试管中,加浓的氢氧化钠溶液,若产生的气体可以使湿润的红色石蕊试纸变蓝,可证明。
。铵根能与碱反应产生氨气,则实验室检验铵根的方法是取少许于试管中,加浓的氢氧化钠溶液,若产生的气体可以使湿润的红色石蕊试纸变蓝,可证明。
(4)S元素在周期表的位置是第三周期第ⅥA,其简单阴离子的结构示意图为 ,证明该粒子的还原性比Z— 强的离子方程式是S2-+Cl2=S+2Cl-。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为16+18=34;最高价是+6价,则其最高价氧化物对应的水化物的化学式为H2SeO4。
,证明该粒子的还原性比Z— 强的离子方程式是S2-+Cl2=S+2Cl-。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为16+18=34;最高价是+6价,则其最高价氧化物对应的水化物的化学式为H2SeO4。
(5)元素Z与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+ NaClO+H2O,其生成的含氧酸盐的电子式为![]() 。
。

 阅读快车系列答案
阅读快车系列答案