题目内容
【题目】火力发电厂释放出大量氮氧化合物(NOx)、SO2和 CO2等气体会造成环境问题对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为____________________。
(2)脱碳。将 CO2转化为甲醇:CO2 (g)+3H2 (g) ![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
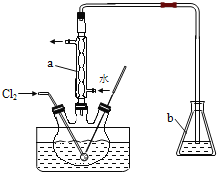
①如图 1,25℃时以甲醇燃料电池(电解质溶液为 KOH)为电源来电解乙(100mL2mol/LAgNO3溶液)和丙(100mLCuSO4)溶液,燃料电池负极的电极反应为_______________。电解结束后,向丙中加入 0.1mol Cu(OH)2,恰好恢复到反应前的浓度,将乙中溶液加水稀释至200mL,溶液的 pH ______________;
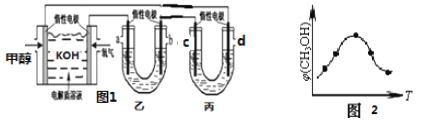
②取五份等体积的 CO2和H2的混合气体(物质的量之比均为 1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数 φ (CH3OH)与反应温度 T 的关系曲线如图 2 所示,则上述 CO2转化为甲醇的反应的△H________3.0 (填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应生成硫酸铵。室温时,向(NH4)2SO4,溶液中滴人 NaOH 溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)________ c(NH3 H2O)。(填“>”、“<”或“=”)
【答案】(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
(2)①CH3OH-6e-+8OH - = CO32- +6 H2O 0 ② <
(3) =
【解析】
试题分析:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加除2,可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①甲醇燃料电池的负极上发生甲醇的氧化反应,碱性电池,氧化产物为CO32-,电极反应式为CH3OH-6e-+8OH - = CO32- +6 H2O;丙溶液需要加入 0.1mol Cu(OH)2,恰好恢复到反应前的浓度,说明电解池中电解了0.1molCuSO4和0.1molH2O,转移电子数为0.4mol,则乙池中转移电子数也为0.4mol,但乙池中只有0.2molAgNO3,完全电解后生成0.2molHNO3,同时电解的是水,电池后H+浓度为0.2mol÷0.2L=1mol/L,溶液的pH=0;
②由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,说明升高温度平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0;
(3)向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,根据电荷守恒可得:C(NH4+)+C(Na+)+C(H+)=C(OH-)+2C(SO42-) ①;根据物料守恒列式可得:C(NH4+)+C(NH4H2O)=2C(SO42-) ②;将①②联立即得:C(Na+)=C(NH4H2O)。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
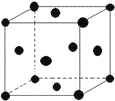
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。