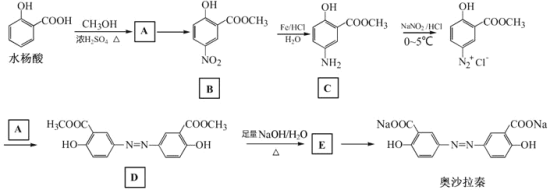
题目内容
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
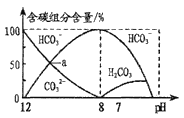
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
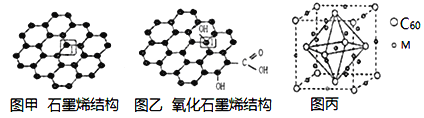
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
【答案】无 sp2 = 氧化石墨烯可与水形成氢键更稳定 12 M3C60 ![]() π×100% 氢键、范德华力 能 二氧化碳替换的水合物
π×100% 氢键、范德华力 能 二氧化碳替换的水合物
【解析】
(1)图乙中,1号碳原子形成4个共价单键;
(2)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键;
(3)氧化石墨烯粒可与水分子形成氢键,稳定性增强;
(4)M原子位于晶胞的棱上与内部,C60分子位于顶点和面心,利用均摊法确定M原子和C60分子的个数比,从而确定化学式;
(5)根据空间占有率=![]() ×100%计算;
×100%计算;
(6)①可燃冰中存在水分子,水分子中存在分子间作用力和氢键;
②依据表格得出二氧化碳的分子直径小于0.586nm,且与水的结合能力为29.91大于16.40。
(1)图乙中,1号碳原子形成4个共价单键,所以其价层电子对个数是4,图乙中1号C与相邻C没有形成π键,故答案为:无;
(2)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键;图甲中1号C的杂化方式sp2。该C与相邻C形成的键角=1200。故答案为: sp2 ;=;
(3)氧化石墨烯粒可与水分子形成氢键,而石墨烯不能,形成氢键使稳定性增强,
故答案为:氧化石墨烯可与水分子形成分子间氢键而石墨烯不能;
(4)如图M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12×![]() +9=12,C60分子位于顶点和面心,C60分子的个数为8×
+9=12,C60分子位于顶点和面心,C60分子的个数为8×![]() +6×
+6×![]() =4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
=4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,
故答案为:12;M3C60
(5)金刚石晶胞如图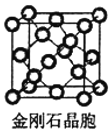 ,该晶胞中C原子个数4+8×
,该晶胞中C原子个数4+8×![]() +6×
+6×![]() =8,金刚石体对角线上的四个原子紧密相连,晶胞棱长a=
=8,金刚石体对角线上的四个原子紧密相连,晶胞棱长a=![]() r,晶胞体积=a3,所有原子体积=
r,晶胞体积=a3,所有原子体积=![]() πr3×8,空间占有率=
πr3×8,空间占有率=![]() ×100%=
×100%=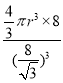 ×100%=
×100%=![]() π×100% ,
π×100% ,
故答案为:![]() π×100% ;
π×100% ;
(6)①CH4与H2O形成的水合物俗称“可燃冰”,分子晶体中作用力是范德华力,水分子之间存在氢键,
故答案为:氢键、范德华力;
②由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,即0.512<0.586,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即29.91>16.40,二氧化碳替换的水合物的相对分子质量大,熔较高;
故答案为:能;二氧化碳替换的水合物。

【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号___,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
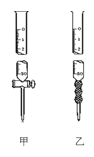
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中,该仪器的名称是___。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:___(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断达到滴定终点的现象是:___。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液的读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.28 |
2 | 20.00 | 0.00 | 18.24 |
通过计算可得,该盐酸浓度为:___mol·L-1(计算结果保留2位小数)。