题目内容
【题目】奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
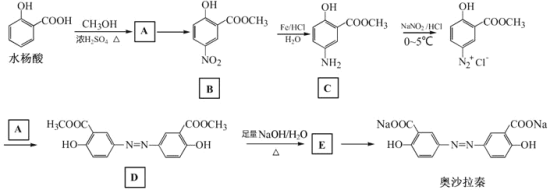
回答下列问题:
(1)A的结构简式为_________;由A制备B的反应试剂和条件为_______________。反应类型为_________。
(2)工业上常采用廉价的CO2与E反应制备奥沙拉秦,通入的CO2与E的物质的量之比至少应为_________。
(3)奥沙拉秦的分子式为_________,其核磁共振氢谱为_______组峰,峰面积比为__________。
(4)若将奥沙拉秦用HCl酸化后,分子中含氧官能团的名称为________________。
(5)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为___________。
(6)写出下列反应的化学方程式:
由水杨酸制备A:____________________________________。
由D生成E:________________________________________。
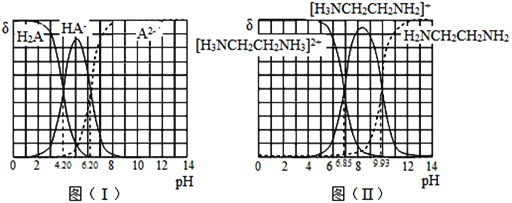
【答案】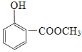 浓硫酸,浓硝酸,加热 取代反应 2∶1 C14H8N2O6Na2 4 1∶1∶1∶1 羧基 羟基
浓硫酸,浓硝酸,加热 取代反应 2∶1 C14H8N2O6Na2 4 1∶1∶1∶1 羧基 羟基 ![]()
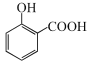 +CH3OH
+CH3OH![]()
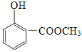 +H2O
+H2O 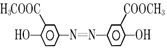 +4NaOH
+4NaOH![]()
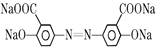 +2CH3OH+2H2O
+2CH3OH+2H2O
【解析】
对比水杨酸、B的结构,结合反应条件,可知水杨酸与甲醇发生酯化反应生成A: ,A发生硝化反应生成B:
,A发生硝化反应生成B: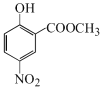 ,B在Fe、HCl、H2O存在条件下-NO2被还原为-NH2,产生C:
,B在Fe、HCl、H2O存在条件下-NO2被还原为-NH2,产生C: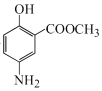 ;C在NaNO2/HCl,并加热在0~5℃时反应产生
;C在NaNO2/HCl,并加热在0~5℃时反应产生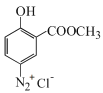 ,
, 与
与 反应产生D:
反应产生D: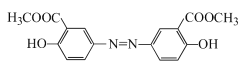 ,D与足量NaOH的水溶液混合加热发生反应产生E是
,D与足量NaOH的水溶液混合加热发生反应产生E是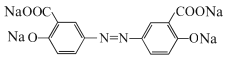 ,向该物质的水溶液中通入足量CO2气体,利用酸性:羧酸>H2CO3>苯酚,发生复分解反应产生目标产物奥沙拉秦
,向该物质的水溶液中通入足量CO2气体,利用酸性:羧酸>H2CO3>苯酚,发生复分解反应产生目标产物奥沙拉秦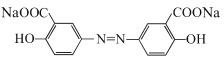 。
。
根据上述分析可知:A是 ,E是
,E是
(1)对比水杨酸、B的结构,结合反应条件,可知水杨酸与甲醇发生酯化反应生成A,所以A的结构简式为: ;A与浓硝酸、浓硫酸混合加热发生取代反应生成B,该取代反应又叫硝化反应,所以由A制备B的反应试剂和条件为:浓硝酸、浓硫酸、加热,反应类型为取代反应;
;A与浓硝酸、浓硫酸混合加热发生取代反应生成B,该取代反应又叫硝化反应,所以由A制备B的反应试剂和条件为:浓硝酸、浓硫酸、加热,反应类型为取代反应;
(2)由于酸性:羧酸>H2CO3>C
(3)由奥沙拉秦的结构,可知其分子中有14个C原子、8个H原子、2个N原子、6个O原子、2个Na原子,其分子式为:C14H8N2O6Na2;该物质分子关于氮氮双键对称,分子有4种化学环境不同的H原子,峰面积之比等于H原子数目之比为1:1:1:1;
(4)由于酸性:HCl>羧酸>H2CO3>C6H5OH,所以若将奥沙拉秦用HCl酸化后可得到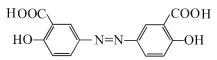 ,该物质分子中含氧官能团为-COOH、-OH,名称为羧基、羟基;
,该物质分子中含氧官能团为-COOH、-OH,名称为羧基、羟基;
(5)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。说明W分子中-OH、-OOCH处于对位的结构简式为![]() ;
;
(6)由水杨酸制备A的反应化学方程式: +CH3OH
+CH3OH![]()
 +H2O;由D生成E的反应化学方程式:
+H2O;由D生成E的反应化学方程式: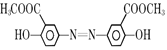 +4NaOH
+4NaOH![]()
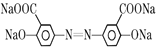 +2CH3OH+2H2O。
+2CH3OH+2H2O。

【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
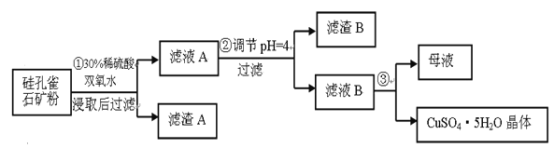
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4+_______+H2O;双氧水的作用是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A.CuO | B.Fe2O3 | C.Al2O3 | D.Cu(OH)2 |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为_____,滤液B中除Cu2+外, 还含有的金属阳离子是_______。
(4)将滤液B通过________、_______,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。