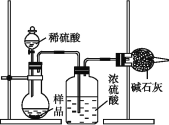
题目内容
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
【答案】B
【解析】
A. 利用三段法计算起始时H2S的物质的量,进一步计算转化率;
B. 根据平衡时各物质的物质的量进行计算;
C. 升高温度,COS浓度减小,平衡逆向进行;
D. 根据Qc与K之间的关系进行判断。
A. 设起始时H2S的物质的量为x mol,
CO(g) + H2S(g) ![]() COS(g) + H2(g);
COS(g) + H2(g);
始(mol) 10 x 0 0
转(mol) 2 2 2 2
平(mol) 8 x-2 2 2
平衡常数K=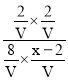 =1,解得x=2.5mol,CO的转化率=
=1,解得x=2.5mol,CO的转化率=![]() ×100%=20%,H2S的转化率=
×100%=20%,H2S的转化率=![]() ×100%=80%,转化率不相等,A项错误;
×100%=80%,转化率不相等,A项错误;
B. 达平衡后H2S的体积分数=![]() ×100%=4%,B项正确;
×100%=4%,B项正确;
C. 升高温度,平衡向吸热的方向移动;升高温度,COS浓度减小,平衡逆向进行,说明正向为放热反应,C项错误;
D. 恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,Qc=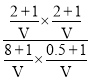 =0.67<1说明平衡正向移动,D项错误;
=0.67<1说明平衡正向移动,D项错误;
答案选B。
Q<K | 反应向正反应方向进行,v正>v逆 |
Q=K | 反应处于化学平衡状态,v正=v逆 |
Q>K | 反应向逆反应方向进行,v正<v逆 |

【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06